Corrosion des métaux: modèle de cellule localisée
La compréhension de la corrosion des métaux par l’eau a été systématisée par le modèle de cellule localisée de corrosion qui décrit le processus électrochimique conduisant à la dissolution des métaux. Ce modèle s’appuie sur la « théorie du potentiel mixte » de Wagner & Traud qui énonce deux principes :
- toute réaction électrochimique peut se décomposer en au moins deux réactions partielles d’oxydation et réduction ;
- il ne peut y avoir d’accumulation nette de charges électriques au cours d’une réaction électrochimique.
Dans ce modèle, la destruction des métaux par oxydation et dissolution est représentée par la réaction :


Cette réaction d’oxydation est définie comme étant le processus « anodique ». Pour satisfaire à l’exigence d’électroneutralité, la réaction doit s’accompagner d’une réaction de réduction ce qui consomme un nombre égal d’électrons :


La réaction de réduction est appelée processus « cathodique ». La réaction combinée d’oxydoréduction, à l’équilibre, est représentée sous la forme :


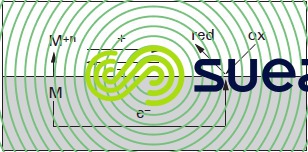
Le processus global est illustré dans la figure 1.
C’est le potentiel global du processus combiné d’oxydoréduction qui détermine si la réaction peut se poursuivre, et donc la possibilité d’une corrosion.


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












