micro-organismes pathogènes
Temps de lecture :Contrairement à la catégorie précédente, il s’agit ici d’êtres vivants dont le parasitisme est la caractéristique commune et qui sont capables de proliférer dans un organisme supérieur (en particulier humain) en provoquant, chez ce dernier, des troubles de santé plus ou moins graves : l’eau n’est pour eux qu’un moyen de transport et un vecteur de contamination. Leur survie y est limitée, mais avec une durée variable suivant les organismes : les formes sporulées ou enkystées sont les plus résistantes ; certains virus ou bactéries peuvent être hébergés par des réservoirs à parasites ; certains vers présentent des formes larvaires qui se développent dans un ou plusieurs hôtes intermédiaires vivant en milieu aquatique (mollusque, crustacé ou poisson). Leur persistance dépend aussi des conditions physico-chimiques du milieu, des prédateurs…
Les micro-organismes pathogènes rencontrés dans les eaux à potabiliser peuvent être de natures très différentes. Leur identification et leur élimination font donc appel à des techniques variées.
Certains d’entre eux n’ont été mis en évidence qu’au cours des dernières décennies, comme :
- les bactéries Legionella, Campylobacter, Helicobacter, Mycobacterium et Escherichia coli souche O157 : H7 ;
- les Rotavirus, les Calicivirus (Norwalk et hépatite E), le Coronavirus du SRAS ;
- les Sporozoaires (protozoaires parasites) des ordres des Coccidies (Cryptosporidium, Cyclospora, Toxoplasma) ou des Microsporidies (Enterocytozoon, Encephalitozoon, Nosema…).
Les raisons de la révélation tardive de ces agents pathogènes appelés « émergents » sont diverses : progrès des études épidémiologiques et des moyens d’investigation, extension de maladies en relation avec certains progrès techniques (ex. : légionellose et installations de climatisation), augmentation des populations à risques (avec notamment l’apparition des malades atteints du SIDA), flux de populations, perturbations écologiques ; parfois, il peut s’agir de souches réellement nouvelles (apparues suite à des mutations, recombinaisons, transferts de plasmides par les bactériophages…), comme c’est peut-être le cas pour E. coli O157 : H7 dont la toxine est voisine de celle de Shigella.
On peut classer ces organismes dans les grands groupes suivants : virus, bactéries, champignons, protozoaires, vers, insectes.
les virus
Les virus (figure 11) sont des agents pathogènes extrêmement petits, visibles seulement au microscope électronique et qui ne peuvent se multiplier qu’à l’intérieur d’une cellule vivante (voir les virus). Lorsqu’une telle cellule a été attaquée par un virus, elle se transforme bientôt dans sa totalité en un amas granuleux de nouveaux virus prêts à infecter de nouvelles cellules.

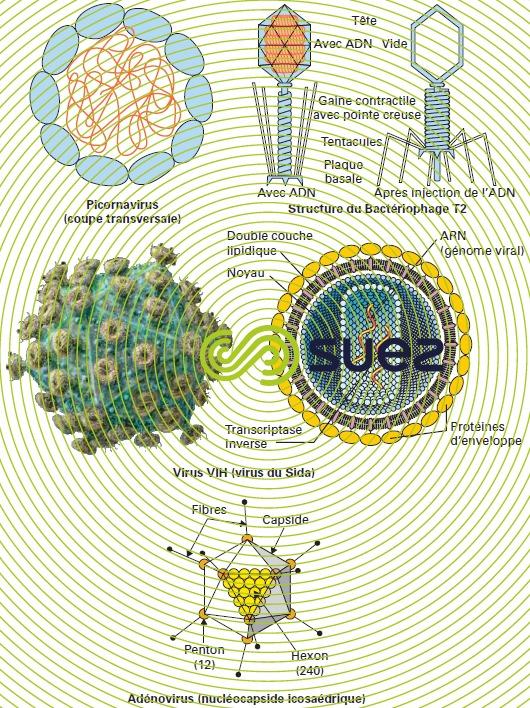

On peut trouver dans l’eau les virus suivants :
- les Entérovirus : ils font partie du groupe des picornavirus (« pico » = très petit – « RNA » – « virus »), qui présentent au total plusieurs dizaines de types différents :
- virus de la poliomyélite qui attaque les centres nerveux (paralysie, méningites lymphocytaires) ;
- virus ECHO (Enteric Cytopathogenic Human Orphan virus), causant une maladie intestinale généralement sans gravité (diarrhée des enfants) ; certains types sérologiques peuvent communiquer des méningites lymphocytaires (réversibles) ;
- les Coxsackie A et B, pouvant provoquer des méningites lymphocytaires, des affections respiratoires, des myalgies ou des myocardies. Ce sont aussi des agents de gastro-entérites infantiles ;
- le Virus de l’hépatite A : c’est l’agent de l’une des plus anciennes maladies hydriques et l’une des plus fréquentes (alors que les types B, C et D se transmettent par les transfusions sanguines ou divers types de contacts entre individus). La maladie est endémique dans certaines régions chaudes, où le virus survit plus longtemps dans l’eau que le poliovirus ou l’échovirus. Ce virus est aussi l’un des plus résistants au chlore ;
- les Calicivirus qui renferment en particulier le virus Norwalk (gastro-entérites) et le virus de l’hépatite E (particulièrement dangereuse pour les femmes enceintes). La contamination se fait par ingestion d’eau souillée, baignade ou consommation de coquillages ;
- les Adénovirus qui attaquent les voies respiratoires supérieures et les yeux (c’est une source de conjonctivite dans les piscines) mais qui sont aussi présents dans l’intestin ;
- les Reovirus, causant des diarrhées, des éruptions cutanées et des maladies de l’appareil respiratoire supérieur ;
- les Rotavirus, identifiés dans de nombreux cas de gastro-entérites (ex. : 64 000 cas en Grande-Bretagne de 2000 à 2003) ; le bétail est souvent à l’origine de la contamination des eaux de surface ;
- le Coronavirus du SRAS, pneumopathie mortelle apparue en Asie fin 2002 et répandue dans le monde en 2003 ; sa transmission est aérienne, mais la présence de virus infectants dans les urines et les fèces des malades montre que la voie hydrique est également possible ;
- l’influenza que les piscines peuvent accidentellement contribuer à transmettre, car le virus est très abondant dans le mucus nasal ;
- le Papillomavirus, responsable des verrues contractées dans les piscines.
En fait, le rôle de l’eau dans la transmission de certaines maladies virales est très controversé. De plus, si l’on se réfère aux rares cas où l’on a pu attribuer une origine hydrique à des épidémies virales, l’eau avait toujours subi une contamination massive par de l’eau d’égout, mais on connaît encore mal les doses minimales infectantes.
Si les virus sont présents dans l’eau, ils s’y trouvent généralement en faible quantité. Il est donc nécessaire de concentrer l’eau à analyser (voir analyses microbiologiques).
les bactéries
Le caractère pathogène est le propre de certains types de bactéries ; toutefois, il existe des germes, habituellement dénués de virulence, qui peuvent manifester une certaine pathogénicité quand les conditions du milieu leur sont favorables ou qu’ils pénètrent, par accident, dans une voie biologique inhabituelle (cas, par exemple, de colibacilles dans le sang).
L’identification des bactéries s’effectue, après isolement, par reviviscence sur des milieux spécifiques par des réactifs chimiques et/ou des réactions de séroagglutination permettant de mettre en évidence tous leurs caractères biochimiques, cytoplasmiques ou membranaires, ainsi que leur virulence (figures 12 et 13).

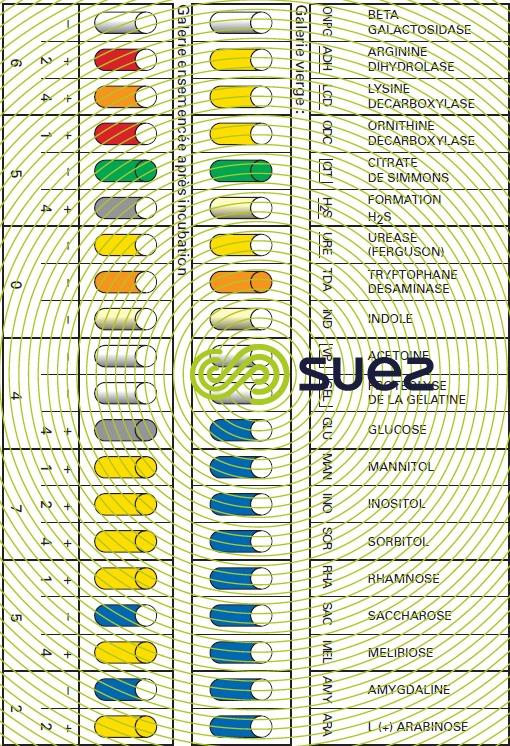


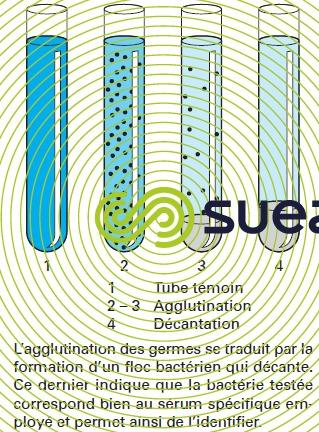

Le contrôle systématique de la qualité bactériologique des eaux, dont le but serait de vérifier l’absence de tous germes pathogènes, procède le plus souvent par voie indirecte en vérifiant seulement l’absence de germes tests de contamination fécale (voir analyses microbiologiques).
Néanmoins, des milieux et des réactions spécifiques ont été développés depuis Pasteur pour mettre en évidence la nature et la virulence de toutes les bactéries pathogènes. Les techniques appliquées sur les eaux dérivent généralement de celles mises au point en milieu hospitalier. La difficulté supplémentaire inhérente au milieu aquatique réside dans la grande dilution des germes recherchés et dans l’état de stress auquel leur séjour hydrique les a parfois conduits. Leur isolement exige donc des techniques particulières de concentration (membranes filtrantes) et de reviviscence (techniques d’incubation à plusieurs paliers de température).
Parmi les principales bactéries pathogènes émises vers le milieu récepteur par les porteurs sains ou malades et pouvant être transmises par voie hydrique à des individus non immunisés, on trouve :
entérobactériacées
- les bacilles des fièvres typhoïde et paratyphoïdes :
- le bacille typhique ou bacille d’Eberth : Salmonella typhi ;
- les bacilles paratyphiques A et B, respectivement Salmonella paratyphi et S. schottmuelleri ;
- les bacilles dysentériques tels que :
- Shigella dysenteriae et Sh. paradysenteriae ;
- Shigella flexneri ou bacille de Flexner (pseudo-dysentérique, forme endémique de la maladie). Les affections gastro-intestinales, qui comprennent les salmonelloses (ex. : Salmonellaenterica) et les shigelloses, ne sont pas toutes bien caractérisées : il y a beaucoup de cas bénins ;
- Escherichia coli (nom commun : colibacille) qui est l’agent de la colibacilloseþ; il existe en fait diverses souches, dont certaines sont inoffensives (E. coli fait partie de la flore intestinale et constitue le principal germe-test de contamination fécale), alors que d’autres sont pathogènes et responsables de dysenteries (c’est l’une des causes de la « turista » des voyageurs), d’infections urinaires et de méningites néonatales. La souche O157 : H7, détectée récemment, est particulièrement virulente (cas mortels aux États-Unis, au Canada, en Écosse…) : elle se fixe sur la paroi intestinale et, tout en provoquant des diarrhées sanglantes, elle sécrète une toxine hémorragique qui est véhiculée dans le sang et peut causer des lésions irréversibles dans les reins, l’intestin, le pancréas et le cerveau.
vibrionacées
- le vibrion cholérique (Vibrio cholerae ou V. comma), découvert par Koch, qui se présente sous la forme de petits bâtonnets arqués flagellés et mobiles. Les épidémies de choléra sont encore relativement fréquentes et une désinfection insuffisante de l’eau potable en est l’une des principales causes dans les pays du Tiers-monde ;
- Aeromonas hydrophila : gastro-entérites et diarrhées.
spirillacées
- Campylobacter (C. jejuni, C. coli) qui, après avoir surtout été considéré en pathologie animale, représente de nos jours une cause d’entérite humaine aussi importante que les salmonelles ou E. coli O157 : H7 ;
- Helicobacter pylori : gastro-entérites, ulcères et cancers du tube digestif.
pseudomonadacées
- le bacille pyocyanique (Pseudomonas aeruginosa) qui est fréquent dans les eaux d’égouts et, de même que Ps. fluorescens, provoque des diarrhées.
parvobactériacées
- Pasteurella (ou Francisella) tularensis qui provoque la tularémie, maladie qui se transmet habituellement d’homme à homme par les insectes hématophages, mais que l’eau peut également contribuer à répandre.
divers
- Proteus morganii qui engendre des diarrhées fétides, surtout chez les enfants, en été ;
- Proteus vulgaris qui provoque des diarrhées, le catarrhe intestinal (ressemblant un peu à la fièvre typhoïde) et des infections diverses ;
- Listeria monocytogenes, responsable de la listériose (sang, méninges, muqueuses) ;
- le staphylocoque doré (Staphylococcus aureus), responsable de nombreuses affections cutanées ou alimentaires (abcès, furonculose, intoxications…), est surtout recherché dans les eaux de piscine ;
- les légionelles (dont la principale espèce est Legionella pneumophila) qui ont été révélées en tant que pathogènes humains en 1976, suite à une épidémie dans un groupe d’anciens de l’American Legion (d’où le nom de « maladie du légionnaire ») contaminés par la climatisation de l’hôtel où ils étaient réunis en congrès. Les infections causées par ces bactéries sont en fait de deux types : une pneumopathie aiguë (légionellose) ou une forme plus bénigne (fièvre de Pontiac). Ces germes sont susceptibles de se multiplier dans les eaux chaudes (installations de climatisation et tours aéroréfrigérantes ; installations d’eau chaude sanitaire ; pommeaux de douches mal nettoyés, où les dépôts et éventuellement la présence d’amibes peuvent favoriser la présence et la multiplication des légionelles) ; leur croissance présente un optimum à 35 °C, mais est inhibée à partir de 55 à 60 °C. La contamination se fait généralement par aérosols (lieux climatisés, bains à bulles, douches…) et le taux de mortalité peut atteindre 10 à 25 % ;
- Leptospira (ou Spirochaeta), en particulier L. icterohaemorragiae qui cause l’ictère hémorragique (leptospirose), très répandu dans le monde. Propagée surtout par l’urine des rongeurs (rat, ragondin), la maladie est contractée par baignade ou ingestion ; les égoutiers en sont parfois atteints.
À côté de ces pathogènes notoires, dont les effets cliniques ont été bien étudiés, il faut ajouter des germes opportunistes qui peuvent présenter une virulence notamment vis-à-vis d’organismes immunodéprimés. Ce sont par exemple des bactéries appartenant aux genres Yersinia (Y. enterocolitica : gastro-entérites et diarrhées), Aeromonas ou Mycobacterium (en particulier le « M. avium complex » ou MAC, qui est très résistant au chlore et infecte le poumon avec des symptômes analogues à ceux de M. tuberculosis).
Ces germes, contrairement aux pathogènes précédemment cités, présentent l’inconvénient d’être adaptés au milieu hydrique. Ils sont, en particulier, capables de se multiplier à des températures voisines de 0 °C et en présence d’un substrat organique dilué, par conséquent dans des conditions proches de celles pouvant être réunies dans un réseau de distribution.
les champignons
Un champignon microscopique infeste parfois les canalisations : Histoplasma capsulatum. Il est l’agent de l’histoplasmose.
Il faut aussi signaler les candidoses (causées par Candida albicans) parfois contractées au cours de baignades en mer.
À part ces observations exceptionnelles, on ne connaît pas d’épidémie d’origine hydrique due à des champignons.
les protozoaires
On peut se reporter au tableau 5 (règne animal) pour replacer les organismes ci-après dans la classification.
les amibes
Sous forme de kystes de 10 à 15 µm de diamètre, elles peuvent subsister plus d’un mois dans l’eau. Elles sont toutefois bien éliminées par un traitement à l’ozone (CT de l’ordre de 2 mg.min/L). Plusieurs espèces véhiculées par l’eau ont une implication importante en pathologie humaine :
- Entamoeba histolytica, parasite strict, agent de la dysenterie amibienne, parfois mortelle (épidémie de Chicago en 1934) ;
- Naegleria gruberi, N. fowleri et Acanthamoeba polyphaga, amibes « libres » mais occasionnellement pathogènes dans les eaux réchauffées : ce sont des agents de méningo-encéphalites à transmission hydrique, notamment dans les piscines et les circuits de refroidissement. Ces amibes peuvent aussi constituer des réservoirs à bactéries (ex. : Legionella) et à virus.
les flagellés
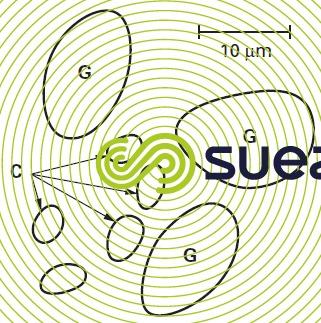
Dans cette catégorie, on retiendra essentiellement la Diplomonadine Giardia lamblia (également appelée G. intestinalis, G.þduodenalis ou encore G. enterica), qui est responsable de nombreuses gastro-entérites (« giardiases ») d’origine hydrique dans le monde. La dissémination est importante en raison de l’abondance des porteurs sains. Sa résistance aux désinfectants est élevée notamment sous sa forme enkystée.
Les kystes (figure 14) sont ovoïdes et ont une taille variant de 8 à 16 µm en longueur et de 6 à 9 µm en largeur ; ils sont assez bien éliminés par les traitements de floculation à des doses optimisées, suivis d’une filtration rapide sur sable.


les sporozoaires
On trouve dans cet embranchement plusieurs parasites « émergents », surtout ceux qui appartiennent à l’ordre des Coccidies (Cryptosporidium,Cyclospora,Isospora,Toxoplasma) dont les formes enkystées (oocystes) sont particulièrement difficiles à éliminer dans les traitements conventionnels ; ils constituent actuellement l’un des moteurs de l’évolution des filières de traitement d’eau potable et du développement des procédés de la désinfection à l’ozone ou aux UV (voir oxydation-désinfection) et encore plus de la filtration sur membranes MF ou UF (voir séparation par membranes et traitement des eaux potables).
- Cryptosporidium (C. parvum), agent de la cryptosporidiose, présente des oocystes de forme presque sphérique, d’un diamètre compris entre 3 et 6 µm ; ils sont donc nettement plus petits que les kystes de Giardia (figure 14). De nombreuses espèces animales (notamment bovins, ovins et caprins) peuvent constituer des réservoirs de ce parasite. Les symptômes de la maladie sont les mêmes que dans le cas de la giardiase (diarrhées, nausées et vomissements, crampes abdominales, maux de tête, fièvre), mais ce parasite est particulièrement dangereux pour les patients immunodéprimés (nourrissons, personnes âgées, malades atteints du SIDA). Pour l’éliminer, le chlore est pratiquement sans effet, l’ozone est actif mais à une concentration très supérieure à ce qui est communément admis et seul un traitement « multibarrières », combinant des séparations solide-liquide (incluant si possible des membranes) et la désinfection (O3 et/ou UV) peut assurer une protection efficace des consommateurs ;
- Cyclospora (C. cayetanensis) : oocystes sphériques de 8 à 10 µm, infectants lorsqu’ils sont sporulés (donc, contrairement à Cryptosporidium, pas immédiatement après leur excrétion). Il ne semble pas que dans ce cas, d’autres mammifères servent de réservoirs à ce parasite. La maladie se traduit par les mêmes symptômes que la cryptosporidiose. Comme dans le cas des autres Sporozoaires, les oocystes résistent bien au chlore ;
- Toxoplasma (T. gondii) : ce parasite présente un cycle à deux hôtes : un mammifère (dont l’Homme) ou un oiseau comme hôte intermédiaire et un félin carnivore comme hôte définitif ; il cause des lésions du cerveau chez les bébés et les malades du SIDA. L’efficacité des traitements pour l’éliminer est encore mal connue ;
- Microsporidies : ce terme collectif désigne un ordre de Sporozoaires dont plusieurs genres sont pathogènes : Enterocytozoon (E. bieneusi), Encephalitozoon (E. intestinalis), Nosema (genre également parasite des insectes), Pleistophora, Trachipleistophora, Vittaforma, plus le genre « fourre-tout » Microsporidium, encore à préciser. Ces organismes forment des spores ovoïdes de 1 à 5 µm de longueur. Les symptômes et les populations à risques sont les mêmes que pour Cryptosporidium, mais mis à part l’utilisation de membranes, on connaît moins bien l’efficacité des techniques de clarification-désinfection sur ces spores.
les vers
Les vers parasites de l’Homme ou des animaux appartiennent au groupe (super-embranchement) des helminthes (du grec helmins = ver), responsables des helminthiases ; ce groupe comporte deux embranchements (voir aussi tableau 5 relatif aux métazoaires règne animal) :
- Plathelminthes (ou vers plats), eux-mêmes subdivisés en deux classes :
- Trématodes (ex. : schistosomes de la bilharziose, douves du foie) ;
- Cestodes (ex. : Taenia, Hymenolepis) ;
- Némathelminthes (ou nématodes, ou vers ronds), comme Ascaris, Toxocara, Trichuris (tous trois les plus fréquemment détectés dans les eaux et les boues résiduaires), l’anguillule, l’ankylostome, la filaire de la dracunculose, l’oxyure (à noter toutefois que l’on trouve aussi de nombreux nématodes libres, non parasites (photo 5), dans les sols, les eaux superficielles et souterraines, de même que dans certains milieux particuliers riches en MO comme les filtres à CAG mal entretenus ou les boues activées).



L’eau peut servir de véhicule à la plupart d’entre eux. Ces vers, leurs larves et surtout leurs œufs ne sont pas détruits par la désinfection aux doses auxquelles elle est habituellement pratiquée ; en revanche, leurs dimensions (voir ci-après suivant les différentes espèces) leur confèrent une bonne aptitude à la décantation et surtout à la filtration : dans les eaux potables bien traitées, ils ne posent donc en général aucun problème. D’autre part, la concentration en œufs d’helminthes résiduels est sévèrement réglementée en réutilisation d’ ERU pour l’irrigation. (< 1 œuf · L–1, voir les effluents urbains).
Beaucoup de ces vers parasites poursuivent leur développement chez plusieurs hôtes successifs différents :
trematodes
Les schistosomes provoquent une grave maladie, appelée bilharziose ou schistosomiase, surtout répandue dans les régions chaudes du globe. Il existe deux formes de la maladie et trois espèces de ce ver parasite :
- bilharziose vésicale (ou urinaire, affectant la vessie), due à Schistosoma haematobium (Moyen-Orient, Afrique tropicale, Madagascar) ;
- bilharziose intestinale, causée par S. mansoni (Égypte, Afrique tropicale, Madagascar, Amérique du Sud) ou par S. japonicum (Extrême-Orient).
L’adulte vit dans les vaisseaux sanguins de l’Homme. L’œuf est ovoïde (50 × 150 µm) muni d’une pointe de 25 µm. Il est excrété avec l’urine, se développe dans l’eau en formant un embryon cilié (miracidium) qui infecte un escargot vivant dans les eaux calmes (bulin, planorbe…). Il s’y transforme en cercaire (larve à queue fourchue) qui retourne dans l’eau et pénètre dans un nouvel hôte humain en traversant la peau (ou la muqueuse buccale). La durée de vie de la cercaire est de deux à trois jours.
On lutte contre cette épidémie en détruisant l’hôte intermédiaire, c’est-à-dire les mollusques : méthodes chimiques (molluscicides), méthodes biologiques, modification de l’habitat des mollusques.
Dans l’eau potable, les cercaires peuvent être éliminées par une filtration sur sable fin (TE max. = 0,35 mm en l’absence de coagulant) ; mais c’est avant tout l’efficacité de la préchloration et de la désinfection finale (chlore ou ozone) qui garantit la destruction des cercaires, à condition de respecter des doses et des temps de contact convenables (par exemple avec le chlore : CT = 10 à 30 mg · min · L–1 suivant l’espèce et la température).
Les douves du foie, responsables de maladies appelées distomatoses ; on distingue la grande douve (Fasciola hepatica) et la petite douve (Dicrocoeliumlanceolatum) ; le ver adulte présente des localisations diverses, mais surtout hépatiques, chez l’Homme et les animaux herbivores (mouton notamment). L’œuf, ovoïde (70 à 130 µm), donne dans l’eau un miracidium, comme dans le cas précédent : celui-ci pénètre dans l’hôte intermédiaire, qui est un mollusque (limnée pour la grande douve, planorbe pour la petite douve) dans lequel il subit une multiplication sous plusieurs formes larvaires, aboutissant à la libération de cercaires qui s’enkystent (métacercaires) sur une plante aquatique, par laquelle les Vertébrés herbivores sont contaminés (cresson sauvage pour l’Homme).
cestodes
Taenia solium (ver solitaire) : œuf sphérique de 35 µm, forme un kyste chez le porc.
Taenia saginata (ténia inerme) : œuf ovale de 25 × 35 µm, s’enkyste chez le bœuf.
Diphyllobothrium latum ou Bothriocephalus latus : adulte chez l’Homme (dans l’intestin grêle, où il peut atteindre une longueur de 20 m) qui est alors atteint d’« anémie bothriocéphalique ». L’œuf ovale, de 45 × 70 µm, se développe dans l’eau, libérant un embryon qui infecte un copépode. Ce dernier étant avalé par un poisson, l’embryon devient larve (8 à 30 mm de long) et se fixe dans les muscles du poisson ; l’Homme est contaminé en mangeant du poisson mal cuit.
nemathelminthes
Ascaris lumbricoïdes : fréquent dans l’intestin grêle de l’Homme et du porc. Le ver adulte mesure 10 à 20 cm de longueur et pond des œufs de forme ovoïde, de 50 × 75 µm. Se développe dans l’eau ou la terre humide en formant un embryon de 0,3 mm qui contamine directement l’Homme.
Oxyurus vermiculis : fréquent chez l’enfant. Œuf ovale (20 × 50 µm) avec une face un peu aplatie. Ne paraît pas vivre longtemps dans l’eau.
Eustrongylus gigas : infecte les voies urinaires. L’œuf elliptique (40 × 60 µm) est plus clair aux deux pôles. L’embryon de 0,25 mm de long infecte un poisson comme hôte intermédiaire.
Ancylostoma duodenale(strongyle) : petit ver de 6 à 20 mm de long qui vit dans l’intestin, perce les muqueuses et provoque des hémorragies et diarrhées très persistantes (ankylostomiase, qui peut être due également à une espèce voisine, Necatoramericanus).
Son œuf (30 × 60 µm) se développe dans l’eau à une température minimale de 22 °C.
L’embryon de 0,2 mm donne une larve capable de traverser la peau pour infecter une nouvelle victime.
Filaria (ou Dracunculus) medinensis(dragonneau, ver de Guinée, filaire de Médine). L’animal est vivipare. L’embryon de 0,5 à 1 mm infecte un copépode (Cyclops) et forme une larve. Ce copépode, avalé avec l’eau, permet à la larve de se développer chez l’Homme. Le ver traverse la paroi de l’intestin et forme des abcès sous-cutanés (dracunculose), avec un risque d’évolution vers le tétanos. L’élimination des copépodes par le traitement de l’eau évite tout risque de contamination, laquelle peut toutefois se produire également par passage direct de la larve à travers la peau.
Anguillula intestinalis : ver de 2 à 3 mm qui habite le duodénum. L’œuf se développe dans l’eau, il se forme un ver (Anguillulastercoralis) qui pond dans l’eau et les larves qui en résultent peuvent contaminer à nouveau un homme par boisson ou par passage à travers la peau.
les insectes
Les insectes aquatiques sanitairement dangereux sont essentiellement les moustiques, dont la larve vit obligatoirement dans l’eau et qui sont les agents de transmission de certaines maladies.
La malaria, ou paludisme, est transmise par l’Anophèle (A. maculipennis, funestus ou gambiae), l’agent de la maladie étant l’hématozoaire de Laveran. La fièvre jaune (typhus amaril) est transmise par Aedes aegypti. Le genre Culex peut également être le vecteur de certaines maladies (encéphalite à virus, filaire de Bancroft).
Une autre filariose, l’onchocercose (ou cécité des rivières, dont l’agent est Onchocercavolvulus), est transmise par une petite mouche, la simulie, dont les larves se développent dans les rivières rapides. La simulie est aussi le vecteur d’une maladie à protozoaires, la leishmaniose.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












