ionisation
Un composé minéral dissous dans l’eau se dissocie plus ou moins avec apparition d’ions chargés négativement (anions) et positivement (cations). Le corps dissous est appelé électrolyte ; il transporte le courant électrique.


Lorsque plusieurs électrolytes se trouvent dans une même solution, chacun se dissocie dans une certaine proportion et les ions libérés peuvent se combiner entre eux pour former des composés nouveaux. Si l’on dissout, par exemple, deux composés AB et CD, on trouvera en solution des molécules AB, CD, AD et CB en équilibre avec les ions A+, B–, C+ et D–. Cet équilibre peut se modifier (loi de Le Chatelier) dans la mesure où il se forme des composés insolubles, des complexes ou des gaz. Si, par exemple, le composé AD est insoluble, l’équilibre est presque totalement déplacé vers la droite, selon la réaction :


Les acides et bases forts ainsi que leurs sels, même en solution relativement concentrée, sont entièrement dissociés. On les appelle électrolytes forts (par exemple, les acides nitrique, sulfurique et chlorhydrique, les bases soude et potasse, le sel chlorure de sodium).
D’autres corps, comme l’acide acétique CH3COOH, le sulfure d’hydrogène H2S, l’acide phosphorique, ne sont que partiellement dissociés en solution. Ce sont les électrolytes faibles. Dans cette catégorie, entrent les polyélectrolytes utilisés par exemple en clarification et comportant plusieurs sites d’ionisation. On distingue l’acidité totale qui comprend tous les ions H+ potentiels, et l’acidité libre qui comprend les seuls ions H+ libres.
L’eau elle-même est partiellement dissociée en ions suivant la réaction réversible :

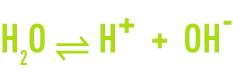
Le proton H+ n’existe pas à l’état libre en solution aqueuse. Chaque ion hydrogène se combine avec une molécule d’eau pour former l’ion hydroxonium H3O+, proton hydraté.

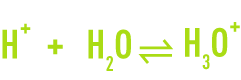
Ainsi, dans l’eau, on trouve à la fois des molécules H2O, des ions hydroxyles OH– et hydroxonium H3O+.
loi d’action de masse
Soit une réaction chimique à l’équilibre :

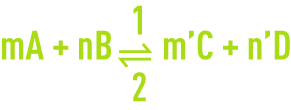
Les vitesses de réaction dans les sens 1 et 2 sont données par les relations :

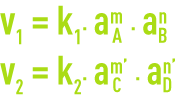
aA, aB, aC et aD représentant les activités des composés en solution.
À l’équilibre v1 = v2, d’où :

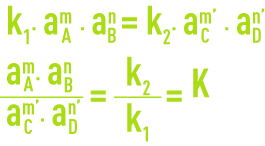
K est appelé constante de dissociation thermodynamique. Pour plus de commodité, on utilise la notation :

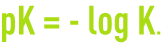
Un tableau (voir constantes caractéristiques de solution - Tableau des pK) donne les valeurs de pK à 25 °C pour les acides et bases usuels ; ces valeurs subissent des variations notables en fonction de la température.
application de la loi d’action de masse à l’eau : notion de pH
Elle s’écrit, en supposant les coefficients d’activité égaux à 1 (hypothèse valable pour les solutions très diluées) :

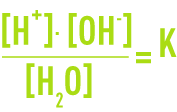
La dissociation étant toujours faible, la concentration des molécules d’eau est pratiquement constante et on peut écrire :


La constante de dissociation (ou produit ionique) de l’eau est de l’ordre de 10–14 (mol · L–1)2 à 25 °C. Elle varie en fonction de la température (voir tableau 7).
Dans l’eau pure,

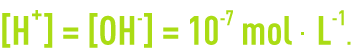
On définit le pH d’une solution aqueuse à partir de la concentration molaire en ions H+ selon :

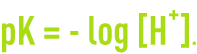
Le pH se mesure par méthode électrométrique (pH – mètre à électrode de verre).



On appelle milieu acide une solution dans laquelle pH < 7, milieu basique une solution de pH > 7.
force des acides et des bases en solution aqueuse
Un acide est un corps capable de céder des protons, c’est-à-dire des ions H+. Une base est un corps capable de fixer ces protons. En solution aqueuse, il existe un couple [acide – base conjuguée] défini par l’équilibre suivant :


En appliquant la loi d’action de masse en solution très diluée avec [H+] = [H3O+] on a :

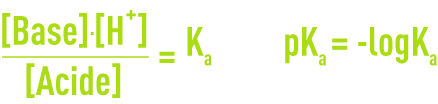
Ka ainsi défini est appelé constante d’ionisation du couple acide-base.
Par exemple, l’acide acétique dans l’eau donne lieu à un équilibre de pKa 4,8 :


Un acide est d’autant plus fort qu’il donne dans l’eau plus d’ions H+, c’est-à-dire que Ka est grand ou pKa faible. Une base est d’autant plus forte que pKa est élevé.
Ainsi, l’ion ammonium NH4+ est un acide faible où pKa = 9,2 à 25 °C. La base correspondante NH3 (NH4OH en milieu aqueux) est une base faible.
hydrolyse des sels
Les sels peuvent être classés en quatre catégories selon la force des acides et bases dont ils sont issus :
- acide fort et base forte (ex. : chlorure de sodium) ;
- acide faible et base forte (ex. : acétate de sodium) ;
- acide fort et base faible (ex. : chlorure d’ammonium) ;
- acide faible et base faible (ex. : formiate d’ammonium).
Les solutions aqueuses de sels des trois dernières catégories peuvent être neutres, acides ou basiques selon les interactions avec les ions provenant de l’eau. Par exemple, pour un sel AB issu d’un acide faible AH et d’une base forte BOH, les anions A– dissociés se combinent avec les protons résultant de l’ionisation de l’eau pour donner l’acide non dissocié AH. En conséquence, la concentration en ions hydroxydes augmente dans la solution qui devient basique. L’équation globale s’écrit :


Par exemple, l’hydrolyse de l’acétate de sodium à la concentration de 0,01 mol · L–1 conduit à une solution de pH égal à 8,4 :


Les solutions de sels de la première catégorie sont toujours neutres car les acides et bases correspondants sont des électrolytes forts.
pH des solutions aqueuses
Les notions de pKa permettent le calcul du pH de solutions d’acide, de base ou de sels de concentration molaire C. À 25 °C,
- le pH d’une solution d’un acide est :

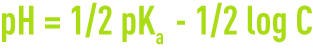
- le pH d’une solution d’une base est :

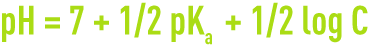
- le pH d’une solution d’un sel est :
- pour un sel d’acide faible et de base forte,

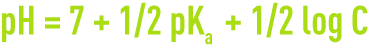
- pour un sel d’acide fort et de base faible,

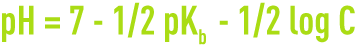
- pour un sel d’acide et de base faibles,

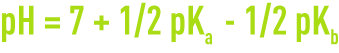
Ka et Kb étant les constantes d’ionisation de l’acide et de la base correspondante.
solubilité des sels peu solubles. Produit de solubilité
L’expérience montre que dans une solution saturée d’un sel AB peu soluble (solubilité inférieure à 0,01 mol · L–1), le produit des concentrations ioniques [A+] · [B–] est constant pour une température et une force ionique données de la solution. Ce produit noté KS est appelé produit de solubilité.
La valeur de KS est d’autant plus faible que le corps est moins soluble. Pour le carbonate de calcium soluble à raison de 12 mg · L–1, le produit de solubilité KS égale 10–8,32 (mol · L–1)2. Par analogie avec le pH on écrit pKS = – log KS.
La présence d’autres sels augmente la force ionique de la solution et en conséquence modifie la solubilité. L’augmentation de la solubilité, appelée effet de sel, est marquée lorsque l’électrolyte ne possède pas d’ion commun avec le sel considéré. Dans le cas contraire, la solubilité diminue. Par exemple, la solubilité du chlorure d’argent est divisée par 1 000 dans une solution à 0,01 mol · L–1 de chlorure de sodium.
solution tampon et pouvoir tampon
Une solution tampon est une solution dont le pH varie peu lorsque de faibles quantités d’acide ou de base sont ajoutées. Ces solutions présentent un intérêt pratique lorsqu’on a besoin qu’une réaction se fasse à pH constant. On les obtient par mélange d’un acide faible et de son sel de sodium ou de potassium, ou d’une base faible et de son sel d’acide fort, par exemple : acide acétique – acétate de sodium (pH = 3,7 à 5,6), hydrogénorthophosphate de sodium – dihydrogénorthophosphate de sodium (pH = 6,0 à 9,0)…
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












