propriétés physiques
Temps de lecture :Les propriétés physiques les plus intéressantes pour le traitement de l’eau sont les suivantes :
masse volumique
Par tassement progressif de l’édifice moléculaire, la masse volumique varie avec la température et la pression.
Pour l’eau pure sous pression normale, elle passe par un maximum à environ 4 °C (exactement 3,982 °C) et sa variation en fonction de la température est la suivante (tableau 1) :



Cette propriété de l’eau entraîne diverses conséquences, aussi bien dans la nature (phénomènes de stratification des lacs) que dans les stations de traitement (ex. : remontées de boues dans les décanteurs).
Aux pressions rencontrées en pratique hydraulique, l’eau est considérée comme un fluide incompressible. Mais, en fait, c’est un fluide légèrement élastique : son volume décroît d’environ 0,048 % chaque fois que la pression augmente d’une atmosphère.
L’eau de mer, de salinité 35 g · L–1, a une masse volumique moyenne de 1,028 1 kg · L–1 à 0 °C ; une variation de salinité de 1 g · L–1 fait varier la masse volumique de 0,000 8 kg · L–1.
Remarque : l’eau pure étant le corps de référence dans les mesures de la densité des liquides et des solides, sa densité est par définition égale à 1,000.
propriétés thermiques
chaleur massique (ou capacité thermique massique)
Très élevée pour un liquide, elle vaut 4,18 kJ · (kg·°C)–1 ou kJ · (kg·K)–1 (soit 1 kcal · (kg · °C)–1 dans les anciennes unités) à 20 °C. Elle varie avec la température en présentant un minimum de 4,178 4 kJ · (kg · K)–1 à 30 °C, pour remonter à 4,215 9 kJ · (kg · K)–1 à 100 °C.
les enthalpies (ou chaleurs latentes)
Les enthalpies de transformation sont pour la fusion de 334 kJ · kg–1 (ou 6,01 kJ · mol–1) et pour la vaporisation de 2 259 kJ · kg–1 (ou 40,657 kJ · mol–1) à la pression normale et à 100 °C.
L’importance de la chaleur massique et de l’enthalpie de vaporisation fait que les grandes étendues d’eau à la surface de la terre constituent de véritables volants thermiques. C’est également la raison de l’utilisation de l’eau comme fluide caloporteur.
viscosité
C’est la propriété que présente un fluide (liquide ou gaz) d’opposer une résistance aux divers mouvements soit internes (ex. : turbulence), soit globaux (ex. : écoulement). Cette résistance est due aux frottements réciproques des molécules en mouvement. Elle est à la base des pertes d’énergie cinétique (pertes de charge) et joue donc un rôle important en traitement d’eau.
On distingue deux types de viscosité :
- la viscosité dynamique (ou absolue) µ définie par le rapport de la contrainte tangentielle de cisaillement T (en Pa) au gradient de la vitesse V (en m · s–1) dans une direction y (en m) perpendiculaire au plan de glissement :

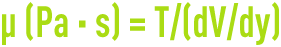
sous-multiple usuel : mPa · s





- la viscosité cinématique v définie par le rapport de la viscosité dynamique µ à la masse volumique ρ du fluide :


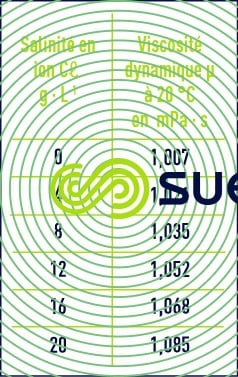
La viscosité de l’eau diminue lorsque la température croît (tableau 2). En revanche, elle augmente avec la teneur en sels dissous ; l’eau de mer est donc plus visqueuse que l’eau de rivière (tableau 3).
La pression agit d’une façon tout à fait particulière sur la viscosité absolue de l’eau.
Contrairement aux autres liquides, une pression modérée rend l’eau moins visqueuse aux basses températures : elle écrase en quelque sorte son organisation moléculaire. Lorsque la pression continue à croître, l’eau reprend une structure de liquide dépourvue de contraint interne et suit la règle générale, c’est-à-dire que la viscosité croît avec la pression.
tension superficielle
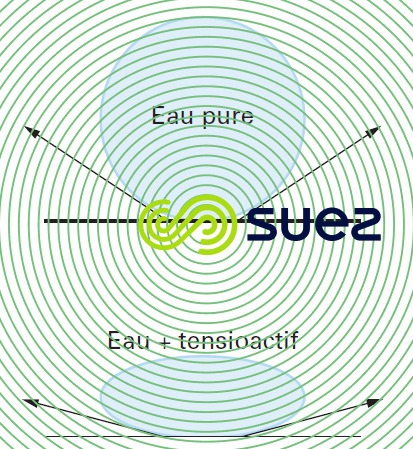
Elle caractérise une propriété des interfaces (surfaces limitant deux phases). Elle est définie comme une force de traction qui s’exerce à la surface du liquide en tendant toujours à réduire le plus possible l’étendue de cette surface (figure 3).
Elle est telle qu’elle provoque une ascension capillaire de 15 cm à 18 °C dans un tube de 0,1 mm de diamètre.
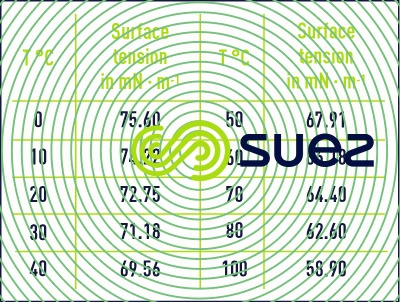
La tension superficielle diminue avec l’augmentation de la température (tableau 4).
L’addition de sels dissous augmente généralement la tension superficielle (= 74,6 mN · m–1 pour une solution aqueuse de NaCℓ à 1 mol · L–1, à 18 °C).
D’autres corps la diminuent, ils sont appelés tensioactifs (ex. :détergents).




propriétés électriques
constante diélectrique
La constante diélectrique de l’eau, de l’ordre de 80 farads stéradian par mètre, est l’une des plus élevées que l’on connaisse ; c’est pourquoi l’eau possède un pouvoir ionisant très important.
conductivité électrique de l’eau
L’eau est légèrement conductrice. La conductivité de l’eau la plus pure que l’on ait obtenue est de 4,2 microsiemens par mètre à 20 °C (correspondant à une résistivité de 23,8 mégohms-centimètres). Elle augmente lorsque des sels sont dissous dans l’eau (voir constantes caractéristiques de solution) et elle varie en fonction de la température.
propriétés optiques
La transparence de l’eau dépend de la longueur d’onde de la lumière qui la traverse. Si l’ultraviolet passe bien, l’infrarouge, si utile au point de vue physique et biologique, pénètre à peine. L’eau absorbe fortement l’orangé et le rouge dans le visible, d’où la couleur bleue de la lumière transmise en couche épaisse.
Cette transparence est souvent utilisée pour apprécier certaines formes de pollution et, en conséquence, l’efficacité des traitements d’épuration ; de même, elle conditionne l’emploi des ultraviolets en désinfection.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












