l'eau solvant
Temps de lecture :Dissoudre un corps, c’est détruire sa cohésion, laquelle est due à des forces électrostatiques ou coulombiennes qui peuvent être :
- interatomiques (liaisons chimiques fortes) : liaisons de covalence (entre atomes), ou ioniques (entre ions) ;
- intermoléculaires : liens de cohésion entre molécules (liaisons de Van der Waals, liaisons hydrogène).
Le pouvoir solvatant de l’eau (molécule dipolaire) provoque l’altération partielle ou complète de divers liens entre les atomes (dissociation) et dans les molécules (ionisation) du corps à dissoudre pour les remplacer par de nouveaux liens avec ses molécules propres (hydratation), et forger de nouvelles structures dispersées. Une solvatation complète est une dissolution.
solubilité des substances chimiques dans l’eau
cas des gaz
La solubilité des gaz obéit aux lois de Henry (voir bases théoriques de l'échange gaz-liquide et constantes caractéristiques des gaz).
À titre d’exemple, la solubilité des principaux gaz à 10 °C, sous une pression de gaz pur égale à 101,325 kPa (1 bar), est représentée tableau 5.



La polarité des molécules les rend plus solubles dans l’eau en particulier pour CO2, H2S mais aussi NH3. De plus ces molécules polaires se dissocient facilement dans l’eau et réagissent avec des ions H+ et OH- et se transforment en ions comme HCO3- et CO3= (pour le CO2) ou HS- et S- (pour l’H2S). On peut donc transférer beaucoup de CO2 dans une eau à fort pH (Ne pas confondre équilibres chimiques et physique).
L’oxygène étant plus soluble que l’azote, les gaz dissous extraits d’une eau sont plus riches en oxygène que l’atmosphère avec laquelle l’eau était en équilibre.
La solubilité du CO2 dans l’eau en équilibre avec l’atmosphère est d’environ 0.7 mg/l, déduite de la solubilité sous atmosphère de gaz pur de 1 bar (cf. tableau) multipliée par la pression partielle du CO2 dans l’atmosphère d’environ 0.03% (0.03% est aussi la concentration en volume par volume). Attention : valeur en augmentation.
cas des liquides
La molécule d’eau étant polaire, la solubilité d’un liquide dans l’eau dépend de la polarité des molécules du liquide considéré. Par exemple, les molécules qui comprennent des groupes fonctionnels OH (les alcools, les sucres), SH, NH2, étant très polaires, sont très solubles dans l’eau alors que d’autres liquides (les hydrocarbures, le tétrachlorure de carbone, les huiles et les graisses…), non polaires, sont très peu solubles.
Il peut y avoir miscibilité partielle : par exemple, une substance n’est miscible en toutes proportions avec l’eau qu’au-dessus d’une température critique (température supérieure à 63,5 °C pour le mélange eau-phénol), ou au-dessous d’une limite inférieure (la triméthylamine n’est soluble en toutes proportions qu’en-dessous de 18,5 °C), ou entre deux températures critiques (ex. : le système eau-nicotine).
cas des solides
L’eau présente un exceptionnel pouvoir de dissolution des sels minéraux. La solubilité dépend de la température. Par exemple à 10 °C (voir tableau 6) :



La dissolution des composés ioniques ou polaires opère par association des molécules d’eau avec les cations via l’atome d’oxygène et avec les anions via l’atome d’hydrogène. La solubilité augmente lorsque le pouvoir polarisant de l’ion, défini par le rapport de sa charge sur le carré du rayon, croît (cas des sulfates de magnésium et de calcium, cas de la soude et du chlorure de sodium). La solvatation des ions crée une organisation des molécules d’eau sur plusieurs couches. La structure des solutions est d’autant plus différente de celle de l’eau pure que les ions sont de petite taille, à haute densité de charge (cas de Li+, Na+, Mg2+, Ca2+, F–, HO–).
Ces ions sont dits structurants de type I : leur solution est plus visqueuse que l’eau à même température. La solvatation des ions de charge et taille moyennes (K+, Cs+, NH4+, NO3–, CℓO4–) produit une perte de structure primitive non compensée par la réorganisation. Ils sont dits déstructurants et conduisent à un abaissement de la viscosité. Les ions très peu polarisants tels que les ions ammonium quarternaires NR4+ (R = groupement alkyle) développent une interaction plus faible avec l’eau : ils sont incorporés dans le liquide sans beaucoup modifier le réseau de liaisons hydrogène de l’eau. Ils sont qualifiés de structurants de type II.
Les composés organiques solides polaires ou aptes à être ionisés sont solubles dans l’eau (cas de l’acide citrique). En revanche, les polymères usuels à longue chaîne non polaire sont insolubles dans l’eau (polyéthylène, PVC, cellulose, polyurée…). L’insertion de groupements fonctionnels polaires autorise une certaine dissolution (par exemple, les détergents, les polyélectrolytes tels que les polyacrylamides).
modification de l’affinité pour l’eau
La solubilité dans l’eau dépend de la nature du corps ou tout au moins de certains de ses groupements constitutifs ; on est ainsi amené à classer les groupements caractéristiques en hydrophiles, c’est-à-dire capables d’établir avec l’eau des interactions d’attraction (OH, CO, NH2…) ou hydrophobes, c’est-à-dire sujets à des forces de répulsion avec l’eau (CH3-CH2, C6H5). L’hydrophilie caractérise donc l’affinité des composés pour l’eau.
hydrophilisation
Dans certains cas, la solvatation nécessite comme intermédiaire un troisième constituant, appelé solubilisant pour les solutions vraies, peptisant pour les solutions colloïdales, stabilisant pour les émulsions et émulsionnant pour les suspensions.
Ces intermédiaires tensioactifs créent de véritables liens entre le solvant et la substance à dissoudre ou à maintenir en dispersion.
Ces agents de surface sont des molécules amphiphiles c’est-à-dire constituées d’une structure carbonée hydrophobe (de type alkyle) terminée par un groupement hydrophile (sulfonate, alcool ou ammonium quaternaire). Les interactions concomitantes de l’extrémité polaire hydrophile avec l’eau et de la chaîne hydrophobe apolaire avec les composés peu solubles entraînent :
- la solubilisation de ces derniers par transfert de phase ;
- leur dispersion par rupture d’interactions hydrophobes intermoléculaires (action des détergents tels que les alkylbenzènes sulfonates, du phosphate trisodique, des lipides membranaires ; action des émulgateurs pour stabiliser les huiles « solubles »).
perte d’hydrophilie
D’autres composés utilisés comme intermédiaires peuvent au contraire rompre le lien entre le solvant et le corps dissous ou dispersé. Selon les cas, cet agent s’appellera précipitant, coagulant, floculant, épaississant. Cette rupture peut être le résultat d’une action chimique : perte d’ions OH– ou neutralisation de groupements ionisés. L’intermédiaire peut détruire l’interaction polaire constituant le lien d’attraction avec l’eau en captant la partie hydrophile ou en adsorbant la partie hydrophobe à la surface de bulles d’air (flottation) ou d’un matériau insoluble plus ou moins hydrophile. La rupture peut être le résultat d’une neutralisation des forces électrostatiques (action des cations polyvalents et des polyélectrolytes).
concentration et activité
La concentration d’un soluté B dans un solvant A peut être exprimée de plusieurs façons :
- fraction molaire xB: rapport du nombre de moles du soluté au nombre de moles total (A+B);
- molarité [B]: nombre de moles de soluté B dissoutes dans un litre de solution ;
- molalité [B]: nombre de moles de soluté B dissoutes dans un kg de solvant A.
Les molécules d’un soluté se comportent dans le solvant comme le ferait un gaz dans un autre. À très grande dilution de soluté, la solution peut être assimilée à une solution idéale obéissant à la loi de Raoult pour l’eau et à la loi de Henry pour le soluté.

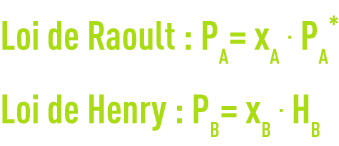
où
PA, PB : pression partielle du solvant, du soluté
xA, xB : fraction molaire de solvant, de soluté
PA* : tension de vapeur du solvant
HB : constante de Henry relative au soluté dans le solvant A.
Quand la concentration devient notable, des interactions entre les molécules de soluté s’établissent et des déviations apparaissent (solutions réelles). Pour en tenir compte, on remplace la concentration en soluté par l’activité relative aB. L’activité, grandeur thermodynamique, est liée à la concentration par un facteur appelé coefficient d’activité, noté g ou f selon l’unité de la concentration :

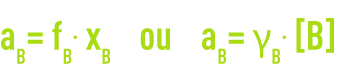
Ce coefficient tend vers 1 quand la solution est très diluée.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












