oxydoréduction
Temps de lecture :Les phénomènes d’oxydoréduction présentent une grande importance dans tous les domaines du traitement de l’eau, toutes les fois que sont impliqués (à titre d’impureté à éliminer ou de réactif de traitement) des éléments capables de changer de nombre d’oxydation (ou valence) : carbone, azote, soufre, fer, manganèse, chrome, arsenic, chlore, ozone…
L’eau elle-même peut participer, suivant les conditions expérimentales, à des réactions d’oxydoréduction avec comme réactions possibles :

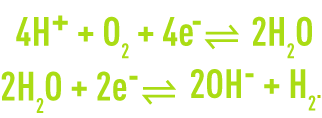
Dans le premier cas, l’eau est donneur d’électrons ; elle est réductrice : l’accepteur d’électrons est un oxydant et de l’oxygène est formé. Dans le deuxième cas, l’eau est un accepteur d’électrons ; elle est oxydante : le donneur d’électrons est un réducteur et de l’hydrogène est libéré.
Mais les réactions sont très lentes en l’absence de catalyseurs et l’on peut en général négliger l’action de l’eau du point de vue oxydoréduction. La force d’un couple oxydant/réducteur communément appelé couple redox est définie par rapport au système de référence H3O+/H2 (électrode standard ou normale à hydrogène, ESH ou ENH ) :


Par convention, la variation d’enthalpie libre standard de la réaction est nulle si la pression d’hydrogène est égale à 1 atm et si la concentration en ion [H3O+] vaut 1 mol · L–1.
Pour un couple redox Ox/Red :



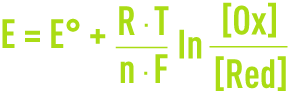
le potentiel donné par une électrode au platine inattaquable plongée dans une solution à la température T (K) contenant à la fois l’oxydant et le réducteur est donné par la relation de Nernst :
où F est la constante de Faraday, R est la constante des gaz parfaits, E° est le potentiel standard du couple Ox/Red correspondant à [Ox] = [Red].
Le potentiel standard permet de prévoir les réactions d’oxydoréduction. Pour qu’une réaction


due à l’interaction des deux couples


soit possible, il faut que E°1 soit supérieur à E°2.
Certaines réactions d’oxydoréduction font intervenir des protons ou des ions hydroxyles (par exemple, l’oxydation de Fe2+ par MnO4–). Pour préciser les conditions de ces diverses transformations, on utilise alors le diagramme potentiel-pH (ou diagramme de Pourbaix), aussi appelé diagramme de stabilité car il définit les zones où les diverses espèces chimiques sont thermodynamiquement stables.
Pour une réaction générale :



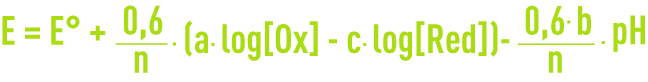
l’équation de Nernst à 25 °C s’écrit :
Le potentiel varie linéairement en fonction du pH et des concentrations en oxydant et réducteur. Les droites E en fonction du pH tracées pour chaque valeur des concentrations délimitent les domaines d’existence thermodynamique des espèces chimiques qui peuvent être solides, gazeuses ou en solution. Le diagramme traduit à la fois des équilibres électrochimiques et acido-basiques (n = 0).
Le diagramme relatif à l’eau est établi à partir des réactions respectives de décomposition et de dissociation suivantes :

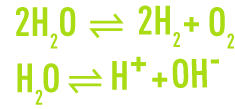
Il fait apparaître (figure 6) :
- une zone I oxydante au-dessus de la droite E = 1,23 – 0,06 pH dans laquelle l’eau se décompose avec dégagement d’oxygène ;
- une zone II réductrice au-dessous de la droite E = – 0,06 pH dans laquelle l’eau se décompose avec dégagement d’hydrogène ;
- deux zones Ia et Ib oxydantes et respectivement acide ou basique, situées au‑dessus de la droite d’équilibre de la réaction de dissociation (pression partielle d’hydrogène égale à deux fois la pression partielle d’oxygène), E = 0,82 – 0,06 · pH, et de part et d’autre de la droite pH = 7 ;
- deux zones IIa et IIb réductrices et respectivement acide ou basique localisées au-dessous de la même droite d’équilibre chimique et séparées par la droite pH = 7.

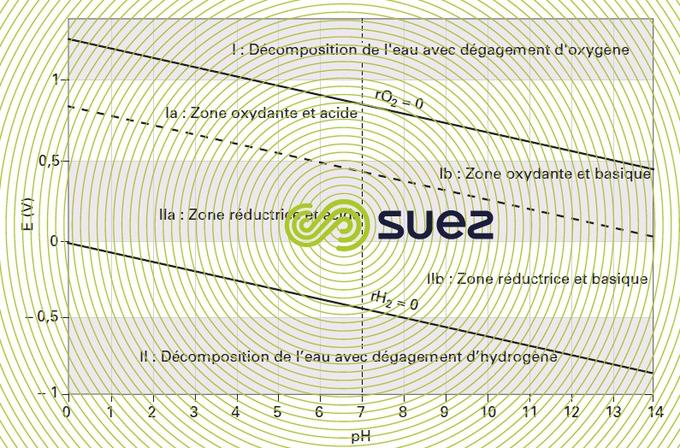

L’eau est thermodynamiquement stable dans les zones Ia, Ib, IIa et IIb. Dans ces zones, seuls les oxydants ou réducteurs très forts réagissent sur l’eau avec une vitesse notable ; par exemple, le chlore passe facilement à l’état d’anion Cℓ–:


Globalement avec l’eau,


avec dégagement d’oxygène et acidification du milieu.
Les indices rH (ou rH2) et rO2 sont définis respectivement comme le logarithme décimal de l’inverse de la pression partielle en hydrogène et en oxygène. L’indice rH sert à caractériser l’état d’oxydation d’un système. Il peut être calculé à partir du potentiel E et du pH selon :

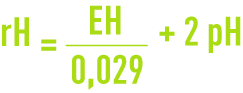
où EH est le potentiel d’oxydoréduction par rapport à l’électrode normale à hydrogène exprimé en Volt.

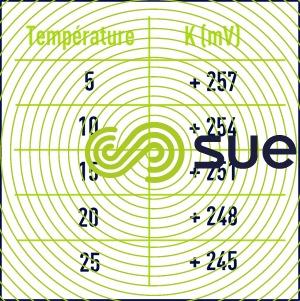

Remarque : on notera que tous les potentiels ci-avant ont été définis par rapport à l’électrode d’hydrogène mais de fait, l’électrode la plus employée sur les appareils de mesure est l’électrode dite combinée platine – calomel (Pt – Hg/HgCℓ2).
La formule suivante permet de passer d’un potentiel à l’autre :

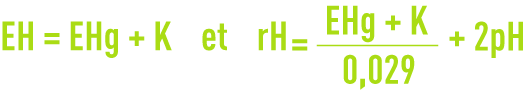
avec :
- EHg : potentiel par rapport à l’électrode au calomel (lu sur l’appareil) ;
- K : constante variant avec la température suivant le tableau 8.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












