Langage des analystes de l'eau
Temps de lecture :Pour traiter l’eau, il faut la connaître et donc pouvoir la caractériser le plus précisément possible. Dans le vocabulaire du traiteur d’eau, certains termes s’écartent sensiblement des termes scientifiques utilisés par ailleurs.
Les paramètres répertoriés ci-dessous sont les plus courants. Ils correspondent directement ou indirectement à des concentrations. On se reportera aux sections Analyses et traitabilité des eaux et Chimie et réactifs pour prendre connaissance des procédures analytiques nécessaires à la détermination de ces paramètres.
turbidité
En relation avec la mesure des matières en suspension, elle donne une première indication sur la teneur en matières colloïdales, d’origine minérale ou organique, qui troublent l’eau (c’est donc une notion opposée à celle de limpidité). Elle est appréciée, soit par la mesure de la limite de visibilité d’un objet défini (fil de platine, disque de Secchi), soit plus scientifiquement par la mesure de la lumière diffusée à 90 ° par rapport à la lumière incidente (voir méthodes de laboratoire avec tableau synoptique) dans des appareils nommés turbidimètres, eux-mêmes étalonnés par des suspensions témoins opalescentes (formazine) dont les résultats sont exprimés en NTU ou NFU ou FAU suivant les conditions opératoires.
matières en suspension ( MES )
C’est la concentration de la partie séchée (hors eau) de tous les éléments en suspension dans l’eau dont la taille permet leur rétention sur un filtre de porosité donnée ou leur rassemblement, sous forme de culot, par centrifugation. Il n’existe pas de relation générale entre turbidité et MES, mais une telle corrélation peut être établie empiriquement pour chaque type d’eau.
indice de colmatage
Il représente le pouvoir colmatant d’une eau. Il est donc aussi en relation avec les matières en suspension et intervient dans les traitements par membranes (voir mesure des paramètres globaux).
couleur
La couleur vraie après filtration est due, le plus souvent, à la présence de matières organiques dissoutes ou colloïdales. Il n’y a pas toujours de relation entre la couleur et la concentration en matières organiques. Elle est mesurée par comparaison à une solution de référence (platine-cobalt) dont l’unité de concentration exprimée en mg · L–1 est aussi appelée degré Hazen.
concentration massique par rapport à un volume liquide
Elle représente la masse de corps dissous ou dispersé dans un certain volume d’eau. Elle s’exprime par exemple en mg · L–1, g · m–3, g · L–1…
concentration en ppm
Une ppm est une partie de corps en solution, mélange ou suspension, par million de parties d’un autre corps (d’eau dans le cas présent). En toute rigueur, ce terme ne devrait s’appliquer qu’à des rapports entre des masses ou entre des volumes (ex. : mg · kg–1), mais la ppm est encore employée dans la pratique du traitement des eaux comme unité de concentration équivalente à 1 g · m–3 ou 1 mg · L–1, la masse volumique de l’eau (pour l’eau pure mv = 1 kg · L–1) permettant cette approximation avec une erreur négligeable.
Dans certains domaines (influence américaine) on utilise de même :
- la ppb : 1 millième de ppm ou 1 µg · L–1 soit 1 mg · m–3 ;
- la ppt : 1 millionième de ppm ou 1 ng · L–1.
équivalent-gramme
L’équivalent-gramme est le quotient de la masse molaire d’un corps par le nombre de charges de même signe portées par les ions que libère en solution aqueuse une molécule de ce corps.
Ainsi une molécule d’acide orthophosphorique H3PO4 libère trois charges positives (3H+) et trois charges négatives (PO43–). Un équivalent-gramme de H3PO4 est donc égal à 1/3 de la masse d’une mole de H3PO4.
Exemple :


normalité
Une solution normale est celle qui contient un équivalent-gramme du corps considéré par litre de solution. On utilise aussi des multiples et des sous-multiples de la solution normale (solutions 10N – N – N/10…).
D’une manière générale, lorsqu’on fait agir sur un volume V1 d’un électrolyte de normalité N1 un autre électrolyte de normalité N2, le volume V2 est déduit de la relation :


Exprimé plus simplement la normalité 1 = 1N du corps considéré correspond à une concentration de 1eq par litre, soit par exemple 1eq H2SO4 = 49 g la solution H2SO4 10N = 490 g/l.
milliéquivalent par litre
On utilise souvent en pratique le milliéquivalent par litre (meq · L–1) qui est la concentration d’une solution N/1 000.
degré français
Il est encore en usage en France pour exprimer les concentrations des principaux ions d’une eau et correspond à la concentration d’une solution N/5 000.


correspondance des divers « degrés »
Le tableau 10 ci-dessous (à lire horizontalement) donne les coefficients de passage entre différentes unités encore en usage.



titre hydrotimétrique ( TH )
Le titre hydrotimétrique représente la concentration en ions alcalinoterreux présents dans l’eau. On distingue :
- le TH total : teneur en Ca et Mg ;
Il est important de signaler que le TH s'exprime en °f, en meq/l, ou en ppm as CaCO3, et qu'il correspond à la somme en Ca et Mg exprimée dans ces unités. Mais jamais en mg/l.
- le TH calcique (ou TCa) : teneur en Ca ;
- la dureté carbonatée : teneur en hydrogénocarbonate et carbonate de Ca et de Mg. Elle est égale au TAC (voir plus bas), si le TH est supérieur au TAC, ou au TH, si le TAC est supérieur au TH ;
- la dureté non carbonatée (dureté permanente) : indique la teneur en Ca et Mg correspondant à des anions forts. Elle est égale à la différence entre TH total et dureté bicarbonatée.
Dureté hydrogénocarbonatée et carbonatée et également appelée dureté temporaire
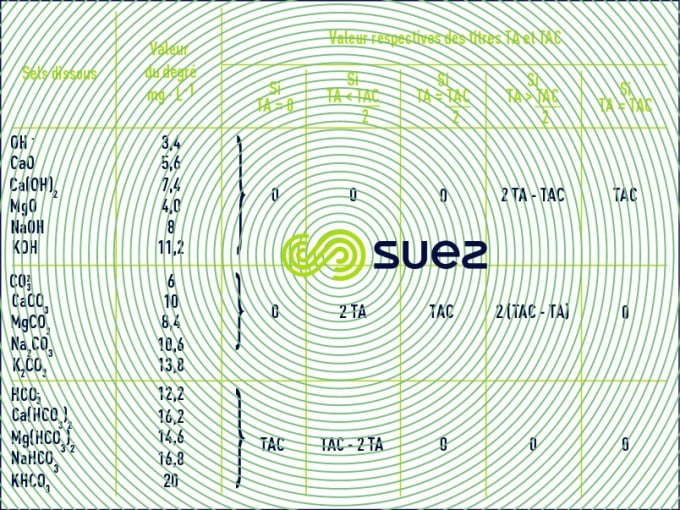
titre alcalimétrique ( TA ) et titre alcalimétrique complet ( TAC )
Les valeurs relatives du TA et du TAC permettent de connaître les teneurs en hydroxydes, carbonates et hydrogénocarbonates alcalins et alcalinoterreux contenus dans l’eau. Le tableau 11 montre que :
- le TA permet de déterminer, en bloc, la teneur en hydroxydes et seulement la moitié de celle en carbonates ;
- le TAC assure la détermination de la teneur composés à réaction basique (hydroxydes, carbonates, hydrogénocarbonates…) jusqu’à un pH d’environ 4.5, donc aussi des acides faibles. Pour une eau naturelle, il représente essentiellement l’ion hydrogénocarbonate HCO3- (appelé aussi bicarbonate).
en °f, en meq/l, ou en ppm as CaCO3
TA : appelé parfois Alcalinité p ( p pour titrage au phénolphtaleine)
TAC : appelé parfois Alcalinité m ( m pour titrage au méthylorange)
Dans certaines eaux très polluées (résiduaires), le TAC recouvre aussi des acides organiques faibles (acétique…). Il peut en être de même dans certaines eaux naturelles très colorées (matière humiques).
titre en sels d’acides forts – SAF
Dans les eaux naturelles il n’y a pas d’acide fort libre ; ne sont présents que des sels de ces acides, surtout sulfates, chlorures et nitrates. Le SAF exprime la teneur globale en sels de ces acides forts en °f, en meq/l, ou en ppm as CaCO3.
salinité
La salinité totale d’une eau correspond à la somme des cations et des anions présents exprimée en mg · L–1.
Le résidu sec obtenu par évaporation est généralement plus faible du fait de la décomposition des hydrogénocarbonates en carbonates et CO2.


oxydabilité au permanganate
On groupe dans cette expression toutes les substances capables d’être oxydées par le permanganate de potassium (KMnO4), essentiellement des matières organiques et parfois des réducteurs minéraux. Cette mesure est pratiquée essentiellement sur les eaux naturelles et potables mais tend à être remplacée progressivement par la mesure du carbone organique. Il existe différentes méthodes (selon la température, le pH du milieu réactionnel, le temps de contact) qui donnent des résultats différents. La plus courante est maintenant celle à chaud en milieu acide, avec une valeur exprimée en concentration en O2. Hors de France, cette mesure est également dénommée « demande en permanganate », voire « DCO », à ne pas confondre avec la mesure suivante.
demande chimique en oxygène ( DCO )
La DCO, pratiquée surtout sur les effluents, correspond à la consommation globale à chaud de l’oxygène du dichromate de potassium et est représentative de la majeure partie des composés organiques ainsi que des sels minéraux oxydables.
demande biochimique en oxygène ( DBO )
C’est la quantité d’oxygène consommée à 20 °C et à l’obscurité pendant un temps donné pour assurer par voie biologique l’oxydation des matières organiques présentes dans l’eau. On utilise conventionnellement la DBO5, c’est-à-dire la quantité d’oxygène consommé après 5 jours d’incubation. La DBO5 n’est représentative que de la pollution organique carbonée biodégradable si l’on prend le soin de bloquer les réactions de nitrification lors de la mesure.
carbone organique total ( COT )
Il représente la teneur en carbone lié à la matière organique, et repose sur une mesure de CO2 après oxy-dation complète.
Cette mesure est, rapide et ne nécessiteant qu’un volume réduit d’échantillon, mais l’appareillage est coûteux. Elle est très utilisée dans le domaine des eaux potables et remplace progressivement l’oxydabilité au permanganate. La corrélation entre les deux mesures est de l’ordre de 1 sur des eaux naturelles. En revanche ces deux paramètres sont difficilement corrélables avec ceux utilisés dans le domaine des eaux résiduaires à cause de la différence de nature des MO.
azote Kjeldahl ( NK, anciennement NTK )
Le NK regroupe l’azote présent sous forme organique et celui sous forme ammoniacale. Il est parfois appelé, à tort, azote total.
azote global ( NGL ) ou total ( NT )
Le terme couvre l’ensemble des formes azotées présent dans une eau, c’est-à-dire azote organique, azote ammoniacal, nitrite et nitrate. Il correspond donc à l’addition au terme NK des formes oxydées de l’azote. On parle également d’azote inorganique (voir normes allemandes) :


mesures sur les effluents décantés 2 h
On utilise parfois en France le suffixe ad2 pour les paramètres DCO, MES, DBO5, NH4…, par exemple DCO ad2 signifiant que la mesure de la DCO a été effectuée sur un échantillon décanté pendant 2 h, donc sans ses matières en suspension grossières.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












