méthodes de laboratoire avec tableau synoptique
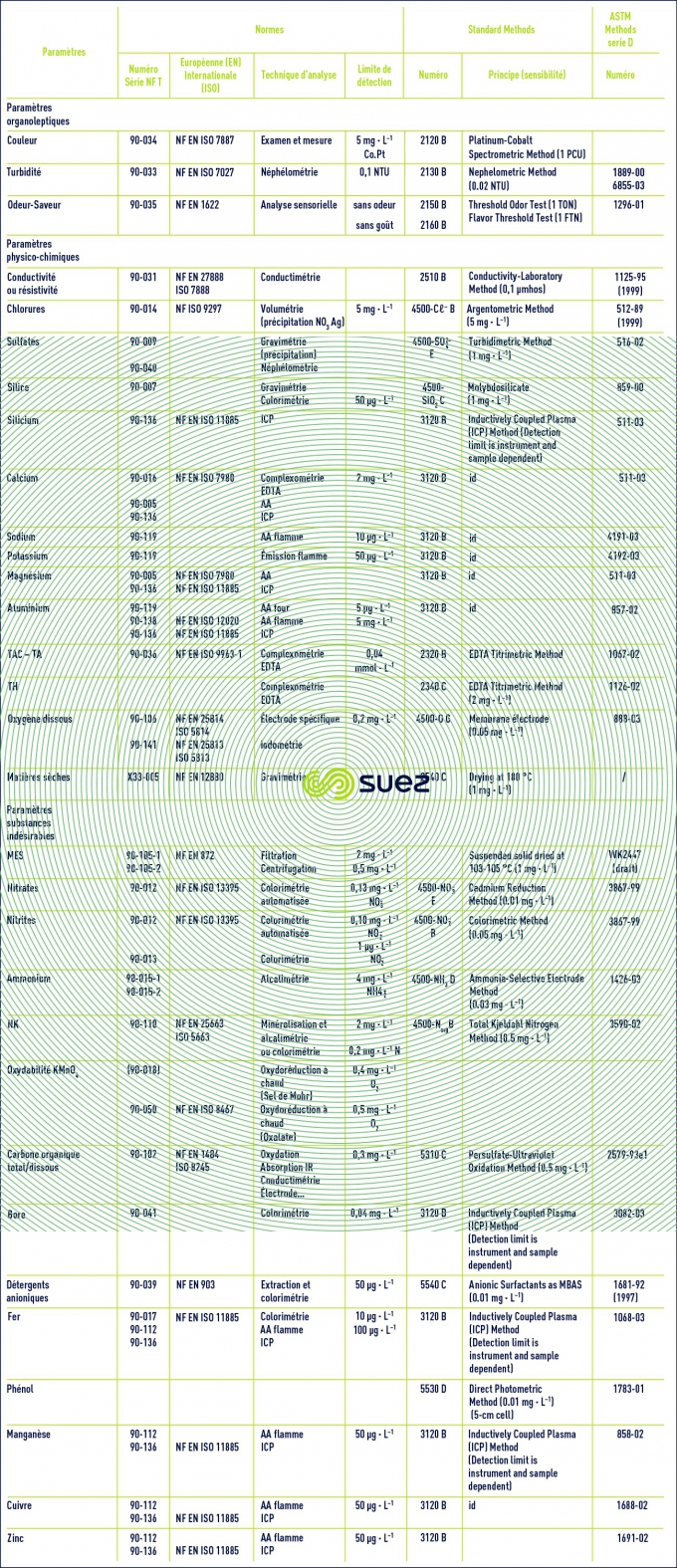
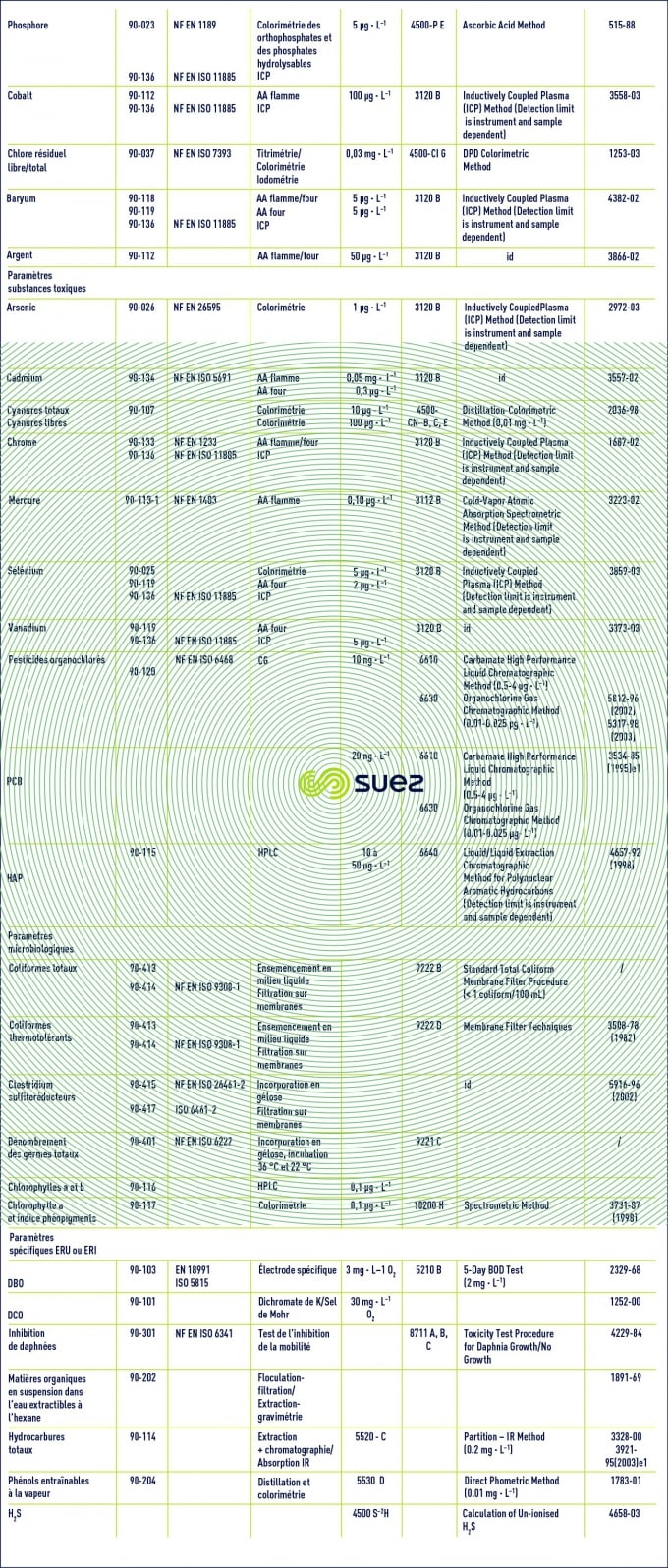
Temps de lecture :Le tableau 2 rassemble les principales techniques analytiques utilisées en traitement des eaux, ainsi que les normes françaises ( AFNOR ), européennes (EN), internationales ( ISO ), ou américaines (Standard Methods ou ASTM ) qui les définissent.
D’autres normes (DIN allemandes, GOST russes…) existent.
concentration préalable
Les méthodes de concentration par extraction sont essentiellement utilisées pour l’analyse des micropolluants organiques. Quatre techniques peuvent être citées :
- extraction liquide‑liquide et concentration du solvant. Le choix du dichlorométhane est souvent retenu pour les déterminations ultérieures des pesticides et des HPA ;
- extraction de composés volatils par la technique de strippage en boucle fermée ( CLSA ) ;
- extraction de composés volatils et semi‑volatils par la technique d’extraction‑distillation simultanée ( SDE ) ;
examen gustatif
Pour une meilleure appréciation des goûts des EP, les techniques de dégustation sont de plus en plus utilisées aussi bien en recherche qu’en contrôle. Deux d’entre elles peuvent être citées
- détermination du seuil de goût ( AFNOR NFT 90.035) : l’eau est diluée avec de l’eau sans goût. La dégustation est effectuée en commençant par les dilutions les plus grandes jusqu’à l’apparition du goût. Le seuil correspond à ce taux de dilution qui doit être perçu par la majorité des opérateurs (équipe d’au moins trois) ;
- détermination du profil de « flaveur ». Cette méthode apporte plus d’informations que la précédente. Un groupe (panel) de dégustateurs entraînés et confirmés (quatre opérateurs minimum) établit un profil d’odeurs, de goûts et de sensations notés chacun sur une échelle d’intensité de 0 à 12. Leurs natures doivent être identifiées parmi une liste de descripteurs.




gravimétrie
Son principe est basé sur la mesure d’une masse égale ou directement proportionnelle à la concentration de l’élément recherché. Parmi les applications, la mesure des MES, après séparation solide‑liquide en est un exemple. La détermination des ions SO42– peut être effectuée par précipitation de BaSO4…
Ces méthodes sont évidemment limitées par la précision des balances.
volumétrie
Par définition, il s’agit de la mesure d’un volume d’une solution titrée proportionnel à la concentration de l’élément recherché. Les réactions mises en œuvre peuvent être :
neutralisation acide base
Lors de la détermination du TA et du TAC par exemple, l’acide titré utilisé est l’acide sulfurique. Des indicateurs colorés ont été choisis en fonction du pH de leur virage.
précipitation
L’exemple de la précipitation du chlorure d’argent par une solution titrée de nitrate d’argent peut être cité. La fin de réaction est mise en évidence par la couleur rouge brun du précipité de chromate d’argent, sel plus soluble que le chlorure d’argent.
oxydoréduction
Dans les cas de l’oxydabilité au permanganate et de la DCO, les oxydants permanganate de potassium et bichromate de potassium sont introduits en excès par rapport aux matières organiques réductrices que l’on cherche à titrer. Un réducteur titré (sel de Mohr par exemple) permet de doser l’oxydant restant. La fin de réaction est une nouvelle fois indiquée par un changement de coloration.
complexométrie
Le TH est déterminé par la complexation des ions Ca2+ et Mg2+ avec une solution titrée complexante EDTA. La fin de réaction est également colorimétrique.
néphélométrie
La mesure de turbidité (voir Langage des analystes de l'eau et Formulaire) utilise ce principe (figure 2). Les particules contenues dans une eau diffusent plus ou moins la lumière. Si un observateur est placé sous un angle de 90° par rapport au rayon incident, il reçoit une quantité de lumière fonction des particules présentes.
Certains appareils comparent la lumière diffusée à la lumière transmise pour tenir compte de matières qui diffusent peu la lumière.

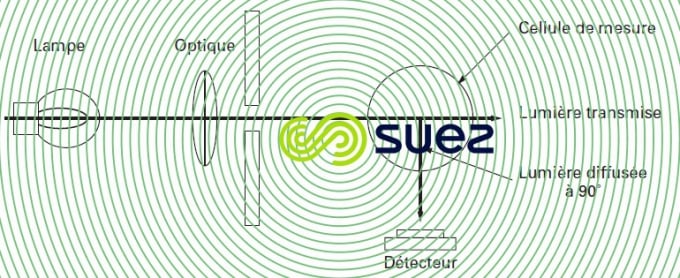

Dans les pays de l’Union européenne soumis à la norme ISO 7027, la mesure doit être effectuée en lumière infrarouge à 860 ± 60 nm et si :
- la turbidité est inférieure à 40, on mesure la lumière diffusée à 90° (résultats exprimés en unité NFU ) ;
- la turbidité est supérieure à 40, on mesure la lumière transmise (résultats exprimés en unité FAU ).
La norme ASTM reste en lumière visible et les résultats sont exprimés en NTU.
Remarque : dans tous les cas, l’étalonnage est fait avec les mêmes suspensions de formazine.
Cette mesure demande des précautions : éviter les bulles d’air, faire des dilutions pour les fortes turbidités. Des mesures comparatives de turbidité ne doivent être effectuées que sur un même appareil.
ampérométrie
Les oxydants tels que chlore, dioxyde de chlore ou ozone peuvent être dosés par ampérométrie. Un courant de dépolarisation entre deux électrodes est proportionnel à la concentration de l’oxydant. Cette propriété permet des dosages en continu sur les réseaux d’eau. En laboratoire, pour des raisons de précision, un réducteur (oxyde de phénylarsène) est introduit, il abaisse le courant jusqu’à un palier caractéristique de fin de réaction. Cette méthode est en fait une volumétrie dont la fin de réaction est mise en évidence par ampérométrie.
ionométrie
La différence de potentiel mesurée entre une électrode spécifique et une électrode de référence est une fonction logarithmique (loi de Nernst) de l’activité de l’élément recherché. L’électrode de mesure du pH, électrode à membrane de verre, reste le meilleur modèle d’électrode spécifique. L’ionométrie est également utilisée pour la mesure du potentiel d’oxydoréduction.
La mesure ionométrique permet, grâce à un jeu d’électrodes spécifiques et d’un ionomètre (pH mètre performant), la mesure d’une quinzaine d’ions. De plus, le couplage des électrodes spécifiques comme électrodes indicatrices dans un dosage potentiométrique donne des résultats très précis.
Les électrodes pour mesure des ions F–, CN–, S2– libres sont les plus utilisées. Les électrodes spécifiques sont de plus très utiles pour les analyses d’éléments sur le terrain mais elles impliquent cependant de maintenir constante la température de l’eau sous analyse et d’imposer au milieu une force ionique donnée.
spectrophotométrie
spectrophotométrie d’absorption moléculaire
C’est la méthode analytique la plus utilisée en analyse d’eau. Elle nécessite la mise en œuvre préliminaire d’une réaction colorée spécifique de l’élément recherché. Elle s’appuie sur le fait que toute solution colorée traversée par un faisceau de lumière ne laisse passer qu’une fraction de la lumière incidente ; la quantité de lumière absorbée est proportionnelle à la concentration du composé coloré recherché (loi de Beer‑Lambert). Cette technique a permis le développement de chaînes analytiques de laboratoire en flux continu, l’utilisation industrielle de photocolorimètres pour la mesure « séquentielle en continu » de nombreux paramètres (silice, ammonium…).
spectrophotométrie d’absorption UV et IR
Dans le domaine de l’eau, ces techniques sont surtout utilisées pour quantifier des familles de MO.
La mesure de l’absorption UV à 254 nm est un indice caractéristique des substances possédant une ou plusieurs doubles liaisons.
La même mesure à d’autres longueurs d’onde complète l’examen (exemple des acides humiques).
La mesure du COT (NF EN 1484) fait intervenir une minéralisation du carbone organique par oxydation chimique et UV (figure 3) ou par combustion, et une détection du CO2 par IR. La limite de détection de la méthode est de 0,2 mg · L–1 et la précision est de 10 %.



L’indice CH2 permet de mesurer les pollutions par les hydrocarbures ; on fait en général appel à une technique fondée sur l’absorption des liaisons – CH, – CH2, – CH3, dans le domaine infrarouge compris entre les longueurs d’ondes 2 800 et 3 000 nm. Plusieurs méthodes opératoires existent dont les champs d’application peuvent être incertains et l’interprétation difficile.
la spectrophotométrie d’absorption atomique ( AA )
Les atomes d’un plasma obtenu par excitation thermique ou électrique peuvent absorber des radiations de longueurs d’onde discrètes et spécifiques.
Dans l’absorption atomique avec flamme (air/acétylène ou protoxyde d’azote/acétylène), l’échantillon d’eau qui contient les éléments métalliques recherchés, est dispersé en nuage de fines gouttelettes dans la flamme. À haute température, les liaisons chimiques sont détruites et les métaux ainsi libérés forment un plasma d’atomes libres. Ce nuage atomique est éclairé à une longueur d’onde caractéristique du paramètre analysé. La quantité de lumière absorbée sera proportionnelle à la concentration de l’élément.
Dans le cas de l’atomisation sans flamme, obtenue par voie électrique, les volumes utilisés sont plus faibles. Le dispositif d’atomisation est constitué d’un tube graphite que l’on chauffe à une température comprise entre 1 500 et 2 800 °C.
la spectrophotométrie d’émission de flamme
La pulvérisation d’une solution d’eau contenant des métaux dans une flamme se caractérise par une décomposition et une dissociation à l’état atomique des traces métalliques. Les atomes des métaux sont ainsi excités thermiquement par la flamme, et leur retour à l’état fondamental s’accompagne de l’émission d’une radiation dont la longueur d’onde est spécifique de l’élément recherché et dont l’intensité est directement proportionnelle à sa concentration. Cette technique est appropriée pour le dosage direct des éléments alcalins : Na, K, Li.
spectrophotométrie de plasma à couplage inductif ( ICP )
La spectroscopie de plasma à couplage inductif est une technique qui fait appel aux phénomènes d’émission atomique dont la source d’atomes est un plasma d’argon. À haute température, il se forme au sein de l’argon un mélange d’atomes et de particules chargés suivant un équilibre :


Le plasma est produit par voie inductive par un générateur haute fréquence.
Sa température varie entre 6 000 et 8 000 °C. Les éléments recherchés sont introduits dans le plasma et transformés en vapeur atomique et éventuellement ionique par excitation lors de leur collision avec les éléments constitutifs du plasma.
Cette technique a un champ d’application plus large que l’absorption atomique sans flamme mais son pouvoir de détection est plus faible. La haute température du plasma permet de limiter les interférences de matrices, et de ce fait l’ ICP peut être très largement employée pour la recherche des métaux lourds, dans les boues de station d’ ERU dont les matrices sont très riches en éléments organiques, et nécessitent une étape de minéralisation en milieu acide.
Tous les spectrophotomètres comportent un système de dispersion de la lumière pour le choix de la longueur d’onde appropriée ainsi qu’un photomultiplicateur pour la mesure de l’intensité reçue.
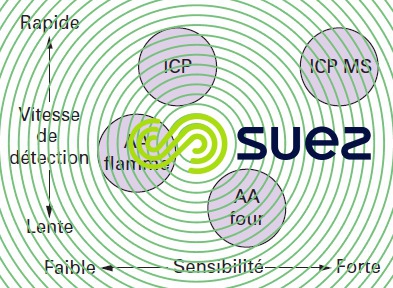
La figure 4 compare la vitesse d’analyse et la sensibilité des diverses techniques d’émission ou absorption atomique pour le dosage des métaux.


fluorescence
La fluorescence est un phénomène de luminescence : des molécules émettent un rayonnement dans toutes les directions grâce à l’énergie reçue d’une lumière incidente. Elle est la propriété des composés cycliques aromatiques.
Sa mesure s’effectue à partir de spectrofluorimètres avec lumière incidente UV et lecture à 90° en lumières UV et visible.
chromatographie
Pour l’identification et le dosage des MO, on a, en général, recours à des techniques chromatographiques.
En chromatographie en phase gazeuse ( CG ), la technique en colonne capillaire est utiliséeen raison de son pouvoir de résolution inégalé, de la disponibilité de détecteurs universels et de son couplage aisé à la spectrométrie de masse ( SM, MS en anglais).
Un chromatographe en phase gazeuse ou liquide comporte trois parties : un injecteur, une colonne de séparation et un détecteur. Après avoir introduit l’échantillon au moyen d’une microseringue par l’injecteur, la séparation des molécules s’effectue dans la colonne par adsorption sélective en fonction d’un gradient de température ou de concentration d’éluant.
À leur sortie de la colonne chromatographique, les composés séparés passent successivement dans un détecteur dont la fonction est de donner un signal. L’intensité de ce signal est proportionnelle à la quantité de composé injecté, elle permet d’assurer, par le biais d’un étalonnage, une analyse quantitative (un exemple de chromatogramme : figure 5). Les détecteurs universels présentent une sensibilité moyenne pour la plupart des composés organiques, alors que les détecteurs « spécifiques » donnent une réponse beaucoup plus intense pour certaines familles chimiques.



Le détecteur universel par excellence est celui à ionisation de flamme (FID). Parmi les détecteurs spécifiques, on trouve le détecteur à capture d’électrons (ECD) sensible aux composés halogénés, le détecteur thermo‑ionique pour des composés azotés et phosphorés, le détecteur à photo-ionisation (PID) pour des composés aromatiques.
La chromatographie en phase liquide haute pression (HPLC) utilise normalement pour phase mobile des solvants aqueux ou organiques. Les techniques de mise en œuvre sont plus diversifiées qu’en phase gazeuse. La chromatographie en phase inverse qui utilise une phase liquide polaire pour éluer une colonne contenant une phase apolaire permet de déterminer les HPA.
La chromatographie ionique (par échange d’ions) permet de séparer un grand nombre de cations et d’anions.
La chromatographie d’exclusion sépare sur gel poreux des composés en fonction de leur taille, et permet de déterminer leur poids molaire apparent ; des fractions de poids molaires différents sont ainsi disponibles pour des analyses complémentaires.
polarographie
La polarographie est basée sur le suivi de courbes intensité de courant‑potentiel. Entre deux électrodes (l’une polarisable généralement à goutte de mercure et l’autre de référence), l’intensité de courant est enregistrée en fonction d’une variation continue de potentiel. La différence d’intensité entre deux paliers est proportionnelle à l’élément oxydé ou réduit. Une des principales applications est l’analyse des cations métalliques et de leurs « spéciations » (degrés d’oxydation, complexation). Des variantes de cette technique améliorent sa sensibilité.
spectrométrie de masse ( SM )
L’utilisation d’un couplage CG-SM permet le dosage des différentes familles de composés chromatographiables en phase gazeuse en utilisant un seul solvant d’extraction (ex. : le dichlorométhane) et une seule séparation chromatographique.
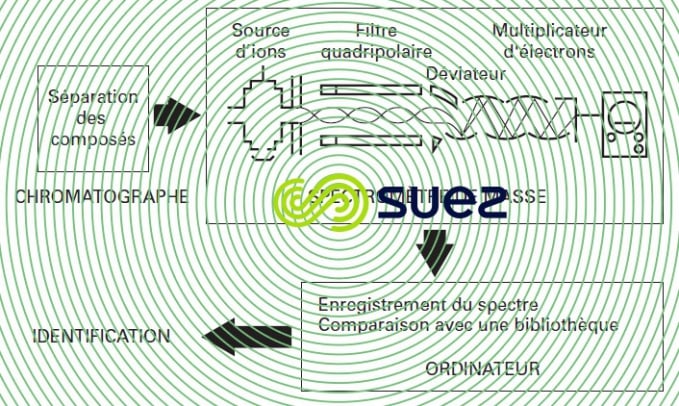
Les composés sortant du chromatographe sont fragmentés par un bombardement d’électrons. L’ensemble des ions détectés (on en mesure les quantités relatives et leurs masses atomiques) constitue le spectre caractéristique de la molécule. L’ordinateur vient au secours du technicien pour l’exploitation des spectres et l’identification des molécules concernées et ceci même en cas de mauvaise séparation sur la colonne, d’où l’intérêt de la spectrométrie de masse par rapport aux détecteurs spécifiques (figure 6).


mesure de la radioactivité
Pour le contrôle des eaux de distribution, les déterminations se font généralement sans séparation chimique préalable, on évalue :
- l’activité globale α ;
- l’activité globale β ;
- la spectrométrie Ɣ.
Dans les cas plus complexes, on procède à des radioanalyses détaillées après séparation chimique. Pour le contrôle des eaux, seules les activités b et g sont généralement prises en compte pour suivre l’évolution de la radioactivité. Toutefois, la radioactivité de l’eau est toujours faible et, de ce fait, peu d’appareils font des comptages corrects. Les types de détecteurs les plus utilisés sont :
- compteur à gaz utilisant l’ionisation (compteur Geiger-Muller, compteur proportionnel) ;
- détecteur à scintillations ou semi-conducteurs, sensible aux rayonnements.
combinaison de techniques
Un grand nombre de déterminations analytiques font appel à plusieurs techniques. Le couplage CG‑SM en est un exemple : séparation suivie de détection.
Les méthodes globales de détermination des MO sont également divisées en deux parties : réaction et détection (tableau 3).



Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












