essais de traitabilité
Temps de lecture :mesures de consommation d’oxygène : respirométrie
Comme déjà vu dans le chapitre Processus élémentaires du génie biologique en traitement de l'eau, les mesures permettant de suivre la consommation d’oxygène d’une biomasse aérobie sont une des méthodes de choix pour connaître soit la biodégradabilité/toxicité des composés d’un effluent ( DBO ), soit l’état d’une biomasse et ses potentialités vis-à-vis d’un effluent donné (cinétique d’élimination de la DBO ou des composants particuliers de la pollution).
mesure manométrique : respirométrie de Warburg
Le respiromètre de Warburg est moins un appareil de contrôle qu’un appareil pour l’étude de l’activité respiratoire des boues activées par voie manométrique, utilisant un échantillon de faible volume (quelques mL) suivant la concentration d’oxygène.
Le respiromètre peut être utilisé pour déterminer les coefficients respiratoires a', b' d’une boue activée comme le montre la figure 14.

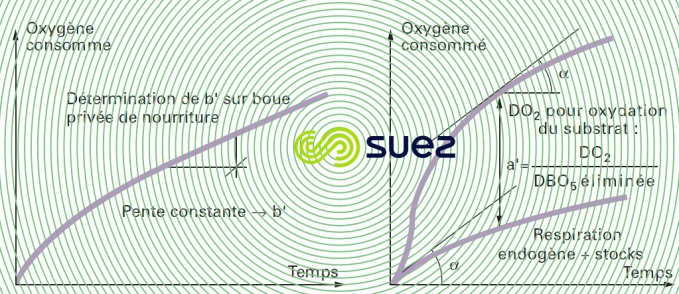

D’un emploi très délicat, les respiromètres de Warburg ne sont en fait pratiquement plus utilisés. Ils sont maintenant remplacés par des systèmes comme celui de la figure 15 qui permettent la mesure directe et en continu de la vitesse de consommation de l’oxygène en réacteur fermé.

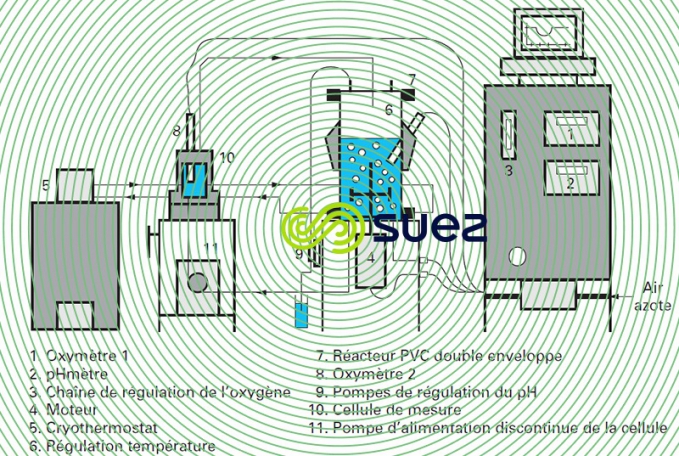

Dans la cellule de mesure 10 (figure 15), en l’absence de toute entrée d’air, la concentration en oxygène dissous décroît linéairement et proportionnellement à l’activité des micro-organismes (figure 16).

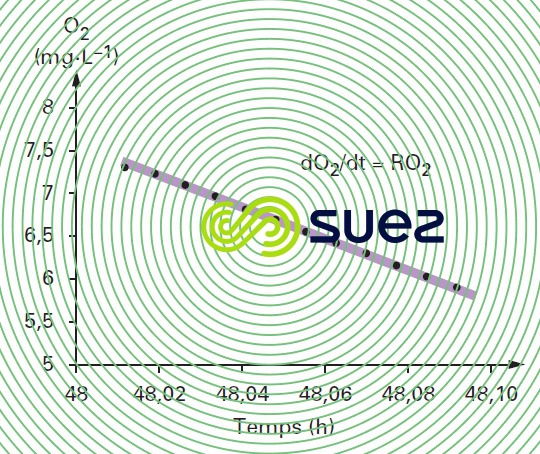

La mesure de la concentration en biomasse du réacteur permet de définir la quantité d’oxygène consommée à la température fixée par le thermostat : gO2 par gMV par h.
Ce respiromètre peut être utilisé pour :
- mesurer la toxicité d’un effluent (en discontinu pour définir un seuil de toxicité ou en ligne en tant qu’alarme pour détection de RO2 anormalement bas) ;
- définir la biodégradabilité d’un effluent (fraction rapidement biodégradable, lentement biodégradable, réfractaire) ;
- la mesure des coefficients respiratoires.
essai de nitrification
Un effluent ensemencé par des boues nitrifiantes ou des souches spécifiques est placé sous aération et agitation dans un flacon. Le suivi des formes de l’azote NO3, NO2 et NH4 est effectué régulièrement. Les courbes d’évolution des espèces azotées permettent d’apprécier la traitabilité et les cinétiques d’oxydation. Ces tests sont appliqués principalement aux ERI quand la présence d’inhibiteur est suspectée.
essai de dénitrification
Cet essai d’orientation permet d’apprécier la cinétique de dénitrification, soit d’une ERI, soit d’une ERU nitrifiée avec ou sans ajout de carbone assimilable (ex. méthanol).
La figure 17 permet de visualiser la mise en œuvre de l’essai. Les flacons utilisés sont obturés par un septum permettant les injections et les prélèvements par seringue sans modifier l’anoxie du milieu (balayage initial à l’azote).

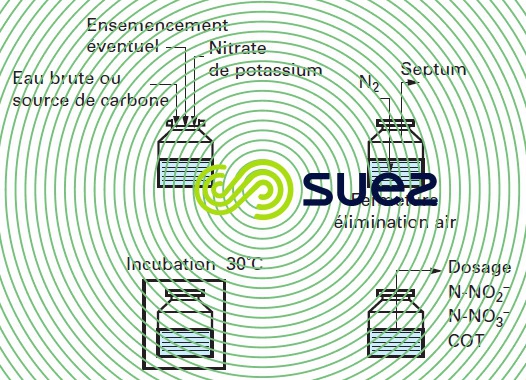

banc d’essai
milieu aérobie
On utilise des réacteurs fonctionnant en continu ou par batch (petit SBR ) dans lesquels l’air est introduit généralement en excès. Les paramètres globaux DCO, DBO en entrée et sortie sont suivis en fonction du temps. Des contrôles continus de pH, potentiel redox, oxygène, COT…, peuvent être mis en œuvre ainsi que les MES, MV, dans le réacteur.
La figure 18 représente un appareil de laboratoire qui constitue une véritable petite station d’épuration avec zones d’aération et de clarification. Les boues activées, après aération, sont envoyées dans la partie inférieure du cylindre de clarification et recyclées par un « émulseur » après avoir été séparées des eaux traitées. Il s’agit là d’un appareil fonctionnant en mélange intégral, ce qui simplifie les relations mathématiques que l’on peut établir à partir des paramètres de fonctionnement observés.

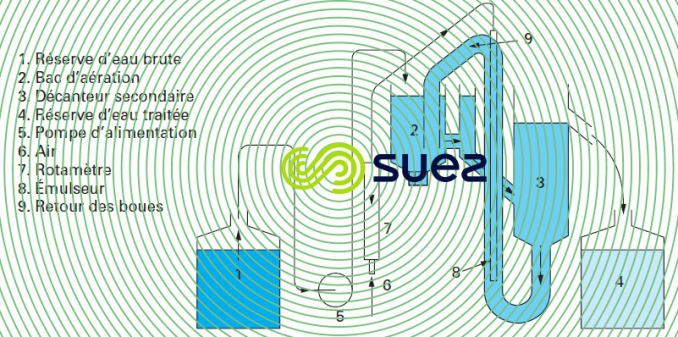

On peut remplacer l’émulseur par une pompe péristaltique, afin de contrôler exactement le débit de recyclage et rendre l’aération indépendante du pompage des boues de retour.
Pour acclimater une boue activée à une ERI difficile, on part généralement d’une boue prélevée dans une station d’épuration urbaine et on alimente le pilote avec un mélange d’eaux urbaines et d’eaux à tester. En une dizaine de jours, on monte progressivement la proportion d’ ERI par paliers d’un à deux jours. Si l’on arrive à 100 % d’ ERI, on en conclut que celle‑ci est traitable ; sinon, on peut déterminer dans quelle proportion il faut la diluer avec une ERU pour qu’elle reste un substrat valable pour les micro-organismes. Bien entendu, cet essai doit être fait sur milieu équilibré naturellement ou artificiellement en carbone, azote et phosphore assimilables.
milieu anaérobie
Des fermentations discontinues sont réalisées dans de petits réacteurs (photo 6), ensemencés par des boues de digesteurs de boues urbaines présentant une population à large spectre. Les opérations initiales se font sous bullage d’azote, puis le flacon est fermé hermétiquement. Les cuvées sont maintenues à 37 °C en étuve sous agitation. Les prélèvements de gaz et d’effluent sont effectués à intervalles réguliers pour contrôler la formation de méthane et l’abaissement de la DCO.
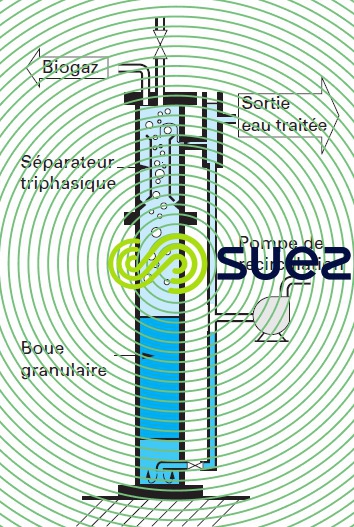
On peut aussi utiliser des réacteurs à culture fixée, à culture mixte ou à lit de boues granuleuses (figure 19) avec une alimentation continue.
Des contrôles de débit et composition du gaz, ainsi que de pH, température, AGV, TAC, DCO…, sont mis en œuvre sur l’alimentation et l’eau traitée.
On peut ainsi déterminer la fraction biodégradable de l’effluent, être renseigné sur les cinétiques de dégradation, voire les phénomènes d’inhibition, voire de toxicité des effluents. (Remarque : une étude doit souvent être prévue sur 3-4 mois vue la longueur des phases de latence et d’acclimatation des boues).





Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












