constantes caractéristiques des gaz
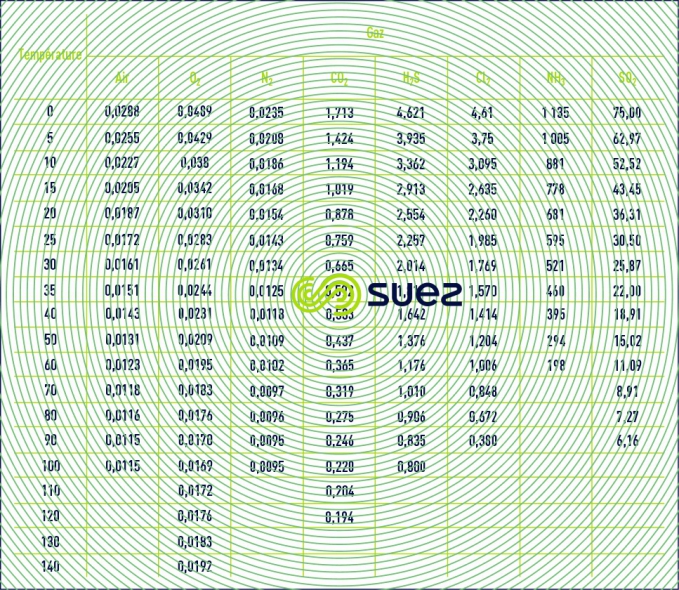
Temps de lecture :masse volumique des gaz (tableau 35)
Si M0 est la masse du litre à 0 °C, la masse du litre à t °C à la même pression est :

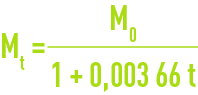
Si M' est la masse du litre sous 101,3 kPa, la masse du litre à la pression réelle P est :

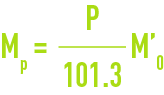
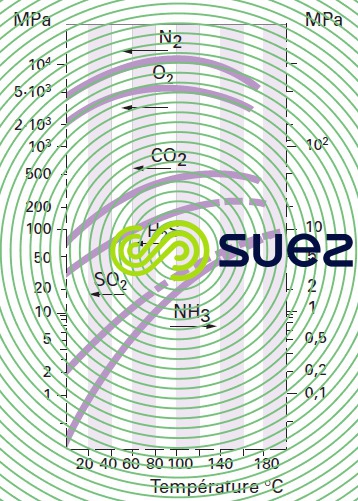
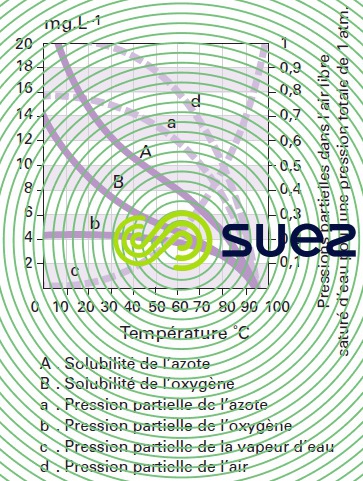
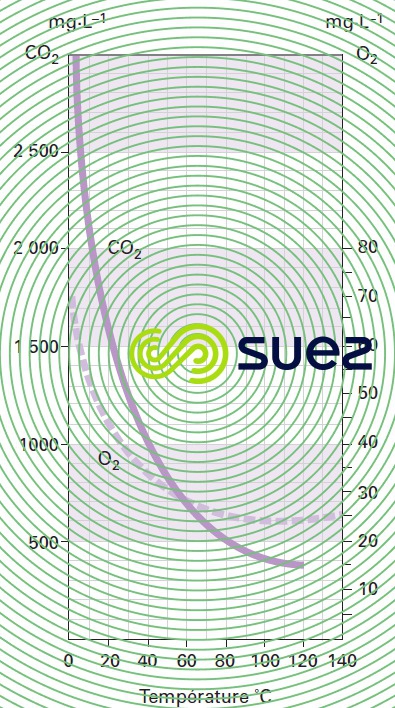
solubilité des principaux gaz dans l’eau (tableau 36, figures 30, 31, et 32)
La formule ci-après permet de retrouver la teneur en gaz dissous dans un liquide à partir de la constante de Henry (figure 30) :


P = pression totale du gaz.
H = constante de Henry dans la même unité que P.
xi = fraction molaire du gaz dans le liquide.
yi = fraction molaire du gaz dans le mélange gazeux











viscosité cinématique de gaz usuels
La viscosité cinématique n fonction de la température, à la pression normale de 101,3 kPa est donnée dans le tableau 37 en m2·s–1.
Cette viscosité doit être corrigée en fonction de la pression d’après la relation suivante (non valable pour la vapeur d’eau) :

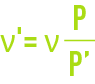
avec :
ν' = viscosité cinématique corrigée, en m2·s–1,
P' = pression absolue réelle,
P = pression absolue normale, exprimée avec la même unité que P'.
La masse volumique ρ' du fluide, en kg · m–3 dans les conditions de température t' (°C) et de pression absolue P' de l’écoulement, se déduit de la masse volumique r dans les conditions normales d’après la formule :

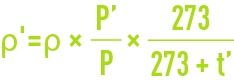



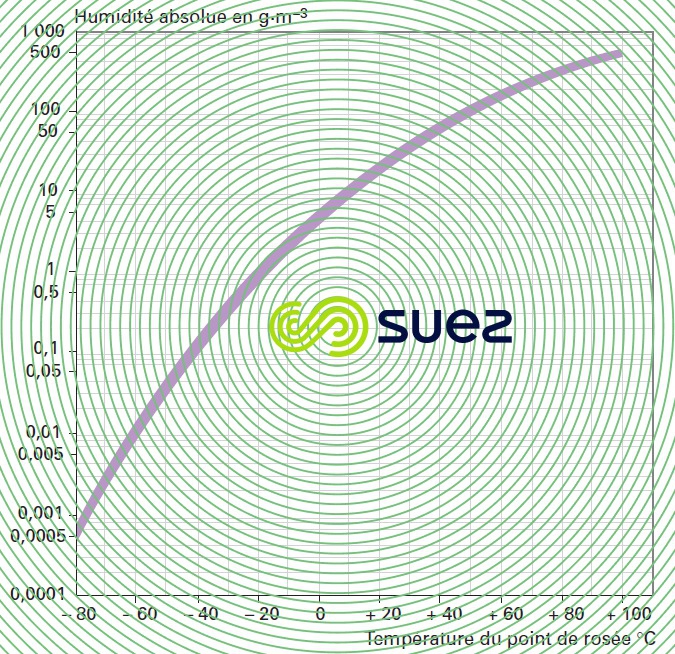
humidité absolue de l’air atmosphérique à la saturation en fonction du point de rosée (figure 33)


chlore
caractéristiques générales
Le chlore est un gaz jaune verdâtre à l’état normal, dont les constantes physiques sont données à la section les oxydants et désinfectants.
À 15 °C et sous 101,3 kPa, 1 kg de chlore donne naissance à 314 litres de chlore à l’état gazeux et 1 litre de chlore liquide correspond à 456 litres de gaz. Il se liquéfie par refroidissement et par compression sous une pression variable avec la température 1 000 kPa à 40 °C ; 500 kPa à 18 °C.

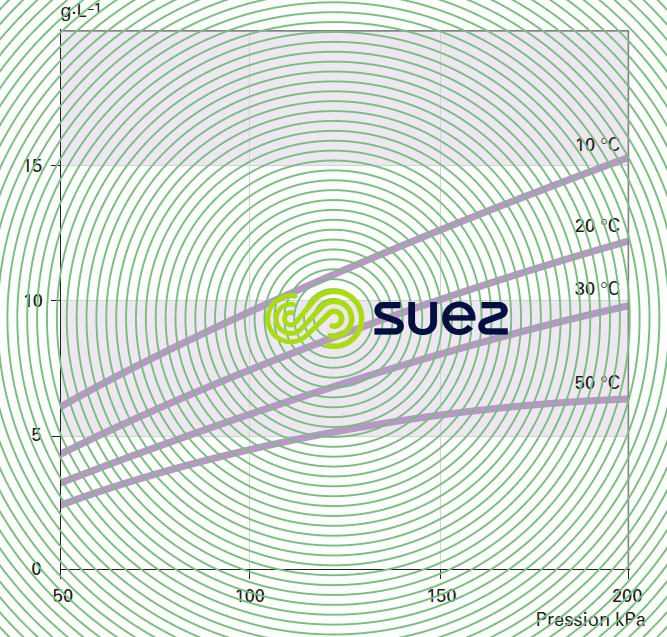

influence de la température et de la pression
Le chlore est un gaz irritant et suffocant qui n’est pas corrosif à l’état pur et sec. Par contre, il est très corrosif en présence d’humidité, même légère. Il se caractérise par une réactivité élevée avec la plupart des corps simples et il est susceptible de donner lieu à des réactions explosives avec l’ammoniac, l’hydrogène…






Masse volumique (figure 35)

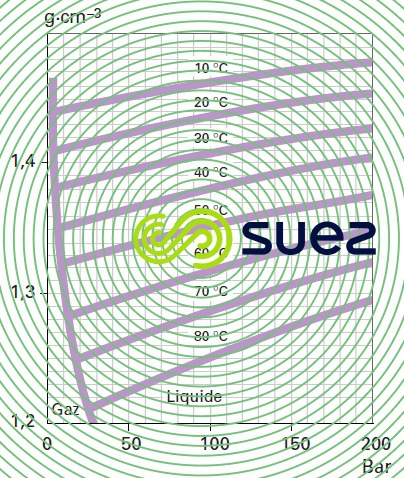

ammoniac



La législation exige des réservoirs timbrés à 2 000 kPa et essayés à 3 000 kPa.
ozone
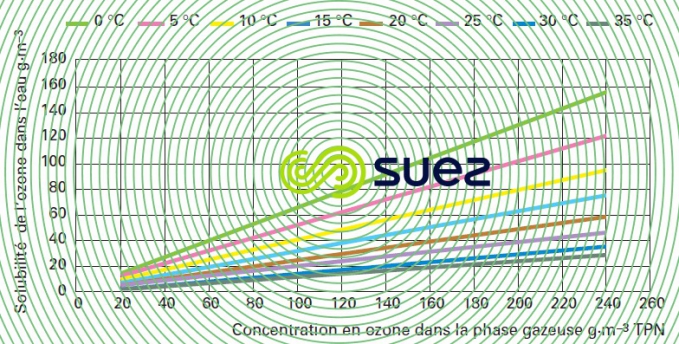
solubilité de l’ozone dans l’eau (figure 36)


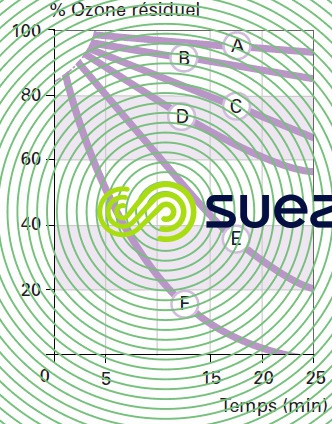
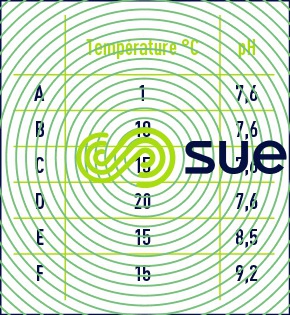
évolution de l’ozone résiduel en fonction du pH et de la température de l’eau




Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












