notions de physique des gaz et thermodynamique
Temps de lecture :gaz parfaits
Un gaz parfait satisfait la loi de Mariotte (dans une transformation isotherme, le produit du volume par la pression est une constante), et la loi de Gay Lussac (dans un volume constant, la pression d’un gaz parfait est proportionnelle à la température absolue).
loi de mariotte


loi de gay‑lussac


lois de dalton
Elle régit le mélange de gaz parfaits : « la pression, l’énergie interne, l’enthalpie et l’entropie d’un mélange de gaz parfaits sont respectivement égales à la somme des pressions partielles, énergies internes partielles, enthalpies partielles et entropies partielles qu’auraient les gaz constituants s’ils occupaient seuls le volume total à la température du mélange », soit :


loi d’avogadro‑ampère


relation qui lie la masse molaire M d’un gaz en g·mol–1 à sa densité d par rapport à l’air dans les conditions normales de pression et de température.
chaleur massique
La chaleur massique est par définition le quotient de la capacité thermique par la masse, la capacité thermique étant la quantité de chaleur dQ qu’il faut fournir à un système pour provoquer une augmentation de température de 1 °C.
Pour un gaz, on distingue la chaleur spécifique à pression constante cp la chaleur spécifique à volume constant cv.
Chaleurs spécifiques cp, à pression constante de quelques gaz en kJ/kg·°C à 0 °C et sous 760 mm de mercure (tableau 85) :





vapeur d’eau
vapeur saturante ou saturée
Vapeur en présence de la phase liquide génératrice ; elle est dite sèche si elle ne contient aucune gouttelette d’eau.
Enthalpie d’une vapeur : c’est la quantité totale de chaleur nécessaire pour transformer 1 kg d’eau prise à 0 °C en vapeur saturée à la température t °C. Elle est la somme de la chaleur d’échauffement de l’eau de 0 à t °C (enthalpie de l’eau) et de la chaleur de vaporisation à t °C correspondant à l’énergie nécessaire qu’il faut fournir pour transformer à t °C 1 kg d’eau en 1 kg de vapeur.
On peut, en première approximation et pour les températures comprises entre 30 et 190 °C, utiliser la formule de Regnault qui donne l’enthalpie en fonction de la température en °C :
- en kJ · kg–1 2 538 + 1,276 t ;
- en kcal · kg–1 606,5 + 0,305 t.
vapeur humide
Vapeur contenant des gouttelettes d’eau, caractérisée par son titre x : masse de vapeur en kg contenue dans 1 kg du mélange.
vapeur surchauffée
Vapeur dont la température est supérieure à celle de la vapeur saturante à la pression considérée. En première approximation elle se comporte comme un gaz parfait.
L’enthalpie d’une vapeur surchauffée peut être calculée par la formule :
- en kJ · kg–1 2 538 + 1,276 t + cp (t – t1) ;
- en kcal · kg–1 606,5 + 0,305 t + cp (t – t1).
t – t1 étant l’écart de température entre la vapeur saturée et la vapeur surchauffée à pression constante. En première approximation on peut prendre cp = 2,1 kJ · kg–1. Cette formule permet en particulier d’estimer l’enthalpie de l’eau évaporée dans un four d’incinération d’où les gaz sortent à la température t, t1 étant dans ce cas égal à 100 °C.
diagramme de la vapeur d’eau









gaz humides
définitions
température sèche
Température d’un gaz humide non saturé mesurée par un thermomètre sec (température au sens habituel).
température humide
Température d’un gaz humide qui se sature au contact d’une nappe liquide.
point de rosée ou température de rosée
Température à laquelle la vapeur contenue dans le gaz commence à se condenser par refroidissement à une température donnée.
pression de vapeur saturante
Pression partielle de vapeur dans le gaz au point de rosée.
humidité relative
Rapport de la pression partielle de vapeur d’eau dans le gaz à la pression de vapeur saturante correspondant à la température sèche de ce gaz. Elle s’exprime généralement en %.
teneur en vapeur d’eau d’un gaz (m)
aussi dénommée « humidité spécifique ou absolue ». Si P est la pression totale du gaz de masse molaire M et pv la pression partielle de vapeur, la teneur m en eau d’un gaz en kg · kg–1 de gaz sec est donnée par :


Ainsi, pour un air saturé d’humidité à 20 °C sous pression atmosphérique normale P = 1,013 bar ; pv = 0,023 bar ; m = 0,0147 kg · kg–1.
enthalpie d’un gaz humide
Les chaleurs de mélange pouvant être considérées comme négligeables, l’enthalpie d’un gaz humide est égale à la somme des enthalpies du gaz sec et de la vapeur.
Pour l’air, l’enthalpie est donnée par les formules suivantes :

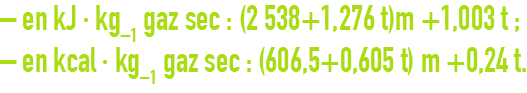
La figure 39 du chapitre les types de traitement des fumées donne les valeurs de l’enthalpie de l’air humide en fonction de sa température et de sa teneur en eau.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












