neutralisation et/ou reminéralisation
Temps de lecture :neutralisation de l’agressivité carbonique
élimination physique du CO2
Les traitements envisageables sont les suivants :
- cascade : ΔH = 1 à 2 m ; résiduel = 10-15 mg CO2 · L–1 ;
- pulvérisation : ΔH = 2 à 5 m ; résiduel = 5-10 mg CO2 · L–1 ;
- aération par diffusion, « moyennes » bulles : G/L (débit air/débit eau) = 1 à 2 ; résiduel = 10-15 mg CO2·L–1 ;
- ventilation forcée en colonne à garnissage (voir élimination de CO2 chap. 16) : G/L = 10 à 100 ; résiduel < 5 mg CO2 · L–1 ;
- stripage en couche fine : G/L = 500 à 1 000 ; résiduel < 2 mg CO2·L–1 ; la teneur résiduelle à viser étant celle qui permet d’équilibrer le TAC et le TCa de l’eau.
neutralisation par voie chimique
Elle se fait le plus souvent par injection de chaux, de soude ou de carbonate de sodium ; les équations des réactions ont été détaillées dans la section neutralisation-reminéralisation. Dans les filières complexes, on peut trouver plusieurs injections échelonnées à différents stades du traitement. Dans les stations comportant une clarification complète, avec décanteurs (ou flottateurs) et filtres, on utilise le plus souvent de la chaux, injectée en deux points au minimum :
- pour régler le pH de floculation (à noter que dans ce cas, du fait des ions Ca2+, la floculation est meilleure qu’avec NaOH ou Na2CO3) ; un lait de chaux peut convenir à ce stade ;
- pour ajuster le pH final à la valeur du pHs ; il convient alors d’utiliser un saturateur délivrant de l’eau de chaux claire et retenant les impuretés de la chaux; en variante, on peut utiliser ici de la soude.
La neutralisation du CO2 agressif peut également se faire par filtration sur produit neutralisant granulé, à base de CaCO3, suivant la même réaction et la même technologie que pour la reminéralisation par ce procédé.
reminéralisation
reminéralisation par CO2 + chaux
Rappelons la réaction mise en œuvre :


À partir de cette équation, on peut calculer que, pour augmenter la minéralisation (TAC et TCa) de 1 °F, il faudra apporter à l’eau 8,8 mg · L–1 de CO2 et 7,4 mg · L–1 de chaux hydratée pure (ou 5,6 mg·L–1 de chaux vive pure).
le CO2
Industriellement, le gaz carbonique est livré en bouteilles sous forte pression mais plus généralement dans des containers réfrigérés dits à « basse pression ».
Dans certaines installations à caractère industriel, le CO2 peut être obtenu par combustion de gaz (brûleurs immergés) mais les impuretés émanant d’une combustion incomplète et/ou du combustible d’origine en interdisent l’emploi pour la production d’eau potable.
En traitement d’eau de mer, le CO2 obtenu lors de la distillation de l’eau de mer peut être récupéré et utilisé pour la reminéralisation de l’eau destinée à la consommation humaine (ex. : Alba/Barhein, 43 000 m3·j–1, voir figure 43).
la chaux
Suivant l’origine, la pureté peut varier de 80 à 95 % ; il faut évidemment en tenir compte dans le calcul des quantités à mettre en œuvre mais également dans la façon dont on va utiliser le produit.
À titre d’exemple, avec un produit « pur » à 90 %, si l’on souhaite augmenter la dureté d’une eau de 8 °F, il faut injecter 59,2 mg · L–1 de chaux pure soit environ 65,8 mg · L–1 de chaux commerciale, ce qui entraînera la pollution de l’eau par 6,6 mg · L–1 de MES si celles-ci ne sont pas retenues dans un saturateur (voir plus loin).
mise en oeuvre
Plusieurs cas de figure se présentent selon la qualité de l’eau brute et celle du réactif utilisé :
- pour une eau distillée qui ne requiert qu’un ajout de sels, il est possible d’introduire le CO2 et l’eau de chaux saturée au moyen de mélangeurs en ligne en réglant le pH au pHs, voire légèrement au-dessus de celui-ci (voir un exemple sur la figure 43) ;

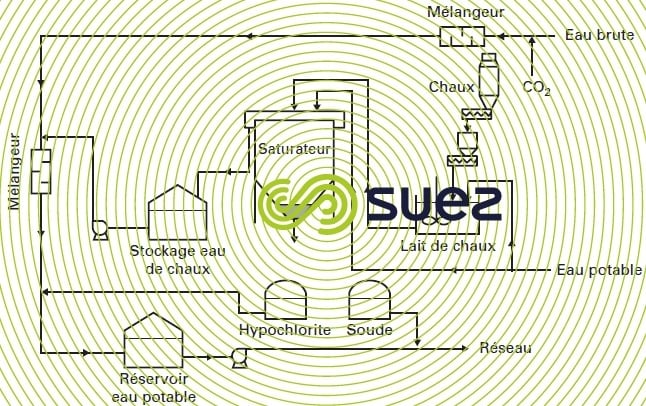

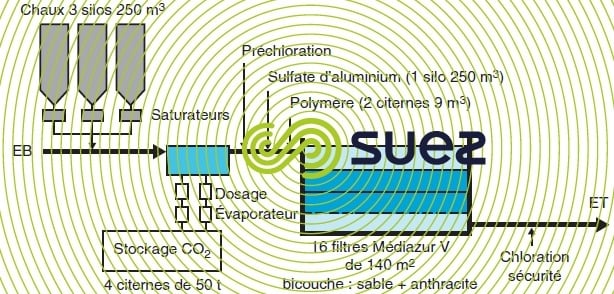
- pour une eau de barrage relativement claire, la mise en contact chaux + CO2 peut être suivie d’une simple coagulation sur filtre. Cette étape de filtration permet d’éliminer les matières colloïdales et les particules en suspension de l’eau brute, ainsi qu’une dose limitée de matières organiques (couleur) ; on peut en voir un ex. de réalisation sur la figure 44 ;


- pour les eaux qui nécessitent un traitement complet de clarification, on pratiquait traditionnellement la reminéralisation à l’aval, c’est-à-dire après décantation et filtration, et pour éviter une dégradation de la qualité de l’eau traitée on a fait appel à des saturateurs de chaux (voir la section chaux) ;
- plus récemment, on a observé que la floculation des eaux douces posait le problème du contrôle du pH. En effet, le faible pouvoir tampon de ces eaux permet rarement de maintenir le pH dans la zone optimale de précipitation du coagulant sans que l’on ait à rajouter un réactif neutralisant ; on a donc proposé de placer la reminéralisation « en tête » avant la coagulation, ce qui présente les avantages suivants :
- le pH est mieux stabilisé (pouvoir tampon des hydrogénocarbonates formés);
- l’utilisation de chaux en tête permet d’injecter celle-ci sous la forme de lait de chaux, les impuretés du produit participant alors favorablement à l’alourdissement du floc lors de l’étape de clarification ;
- il faut néanmoins un saturateur pour l’ajustement final du pH à la chaux, mais sa taille est réduite ;
- le bon contrôle du pH de coagulation permet une élimination optimale des matières organiques et un respect plus facile des normes en coagulant résiduel dissous (Aℓ surtout).
En revanche, un certain nombre de processus intervenant à l’aval de la décantation peuvent requérir une eau à pH plus élevé (précipitation du Mn, nitrification biologique de NH4+…). On devra donc se poser la question de la place de la reminéralisation : soit en amont du décanteur, soit entre décanteur et filtres.
Une solution souple consiste à prévoir les deux possibilités en laissant à l’opérateur le choix des conditions optimales en fonction des caractéristiques de l’eau brute qui ont tendance à évoluer au cours des saisons.
Dans cette hypothèse, on gardera toujours une dose minimale de CO2 en tête pour contrôler le pH et on ménagera un point de mélange des réactifs (chaux et CO2) avec l’eau décantée avant les filtres, ceci afin de permettre un contrôle efficace du pH dans le but d’éviter les redissolutions d’aluminium.
temps de contact
Le temps de contact varie en fonction de la température et de la concentration du lait ou de l’eau de chaux (de 2 à 8 min en général).
contrôle du procédé
L’efficacité du procédé « chaux + CO2 » est tributaire d’un grand nombre de paramètres :
- qualité de l’eau brute : pH – TAC – MO – température ;
- qualité des réactifs et/ou concentration des solutions mères ;
- débit des réactifs : stabilité des pompes doseuses.
Son utilisation a donc été traditionnellement réservée aux grandes stations de traitement d’eaux de surface pour lesquelles une clarification s’impose et qui de ce fait jouissent d’une instrumentation et d’un personnel de contrôle plus étoffé.



reminéralisation par CO2 + calcaire
réaction
La réaction théorique est la suivante :


Pour augmenter le TAC et le TCa de 1 °F, il faudra donc utiliser en théorie 4,4 mg · L–1 de CO2 et 10 mg ·L–1 de CaCO3.
réactifs
Le carbonate de calcium utilisé couramment en France est une forme particulière intéressante pour sa réactivité liée à son état physique : le lithotamne (ou maërl) vendu sous différents noms commerciaux, dont ceux de « Neutralite », « Neutralg », « Timalite »… Il est constitué de débris d’algues fossiles de type corallien (Lithothamniumcalcareum) dont il existe des gisements importants au large de la Bretagne.
D’autres formes de calcaires plus ou moins finement broyés sont utilisables mais on devra adapter en conséquence les temps de contact définis ci-après.
La constitution chimique du lithotamne est assez peu variable, avec une part prédominante en carbonate de calcium, 5 % à 10 % de carbonate de magnésium et quelques impuretés.
Les réactions de neutralisation sont donc :

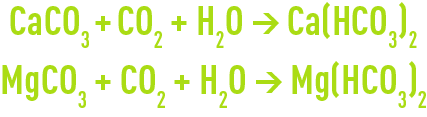
En fonction du rapport CaCO3/MgCO3 et du % de pureté du produit commercial, la consommation de calcaire marin pourra varier de 2,2 à 2,4 kg par kg de CO2 neutralisé.
On a parfois proposé l’utilisation de produits à base de magnésie plus ou moins calcinée (mélange CaCO3, CaO, MgO). Ces produits sont plus réactifs et nécessitent donc des temps de contact plus faibles ; cependant, la présence de bases libres peut conduire à pH > pHs et rendre l’eau fortement entartrante, notamment pendant les périodes d’arrêt prolongé ou de baisse du débit par rapport au débit nominal. Un contrôle précis doit donc être effectué.
mise en contact
Du carbonate de calcium en poudre peut être utilisé par injection d’une suspension dans l’eau contenant le CO2 à neutraliser, mais cette méthode n’est applicable que pour les eaux de surface qui requièrent une clarification et l’emploi d’un décanteur.
Un décanteur à lit de boue est alors particulièrement adapté car il concentre la suspension et permet des temps de contact élevés (30-45 min) ; en outre, les impuretés du carbonate contribuent à « lester » le floc ce qui lui confère une meilleure décantabilité.
Plus généralement, les « calcaires marins » sont commercialisés en grains et sont mis en contact dans des « réacteurs-filtres », gravitaires ou sous pression, où l’eau à traiter percole à travers le matériau. L’efficacité de tels systèmes dépend :
- de la réactivité du produit utilisé (porosité, densité) ;
- de la granulométrie ;
- de la température ;
- du TAC initial de l’eau brute ;
- du temps de contact.
La figure 45 donne un exemple d’abaques disponibles pour le dimensionnement des réacteurs à calcaire marin granulé (pour la fourchette granulométrique de 1 à 2 mm). On définit la quantité de CO2 à neutraliser en fonction de la qualité de l’eau brute et de la minéralisation à atteindre et le graphe donne le temps de contact minimum à respecter.

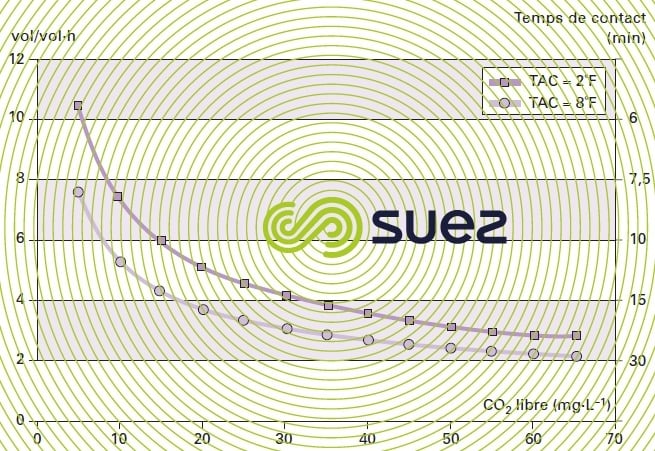

Le résultat est exprimé soit en temps de contact (min) soit en vol·vol–1·h–1. En pratique, il est souhaitable de déterminer expérimentalement les temps de contact dans chaque cas, du fait de la multiplicité des paramètres à prendre en compte : la température, le TAC de l’eau, le mode de mise en contact, la forme du matériau (poudre, grains…) et surtout la valeur admissible du CO2 résiduel car il est très difficile, sauf à utiliser un temps de contact infini, d’obtenir un résiduel de CO2 agressif nul.
En pratique, sachant qu’au mieux on peut s’approcher de l’équilibre à 0,1 unité de pH, alors que la plupart des cahiers des charges demandent à ce qu’il soit dépassé (pH = pHs + 0,1 à 0,2), on choisira donc l’obtention d’un pH inférieur au pHs à 0,2 ou 0,3 unité près à la sortie du filtre (on laisse donc 1 à 2 mg·L–1 de CO2 agressif) et ensuite on ajuste le pH final à la soude (neutralisation finale).
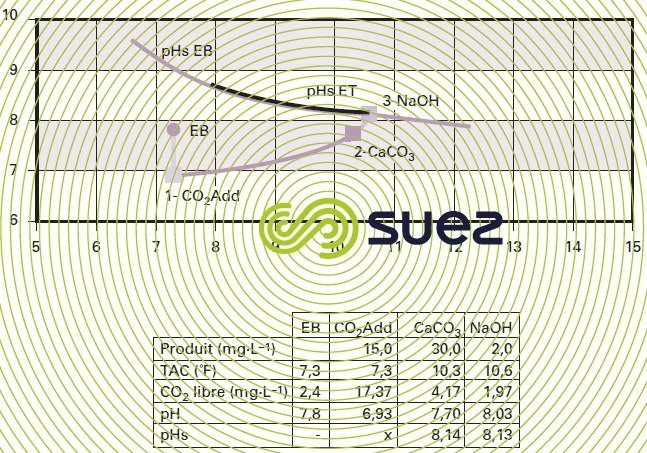
L’évolution du couple TAC-pH de l’eau peut être suivie sur le graphique « Calcograph » (voir un exemple sur la figure 46).


consommation de calcaire marin : autonomie/lavage
Le fait que le produit utilisé se dissolve au fil du temps a deux conséquences :
- la diminution du volume de produit entraîne une diminution du temps de contact, il faut donc envisager des rechargements périodiques qui seront à calculer en fonction du CO2 à neutraliser ;
- la dissolution progressive des grains entraîne la formation de fines qui ont tendance à colmater le matériau, ce qui implique un lavage régulier et efficace (lavage air + eau).
traitement complémentaire : désinfection
La mise en place d’une neutralisation sur calcaire peut s’accompagner d’une dégradation de la qualité bactériologique des eaux produites (les matériaux poreux se colonisant facilement).
Il faudra donc :
- contrôler la qualité bactériologique du produit à la livraison et après stockage ;
- effectuer des lavages efficaces à fréquence fixe sans tenir compte de la perte de charge (au moins une fois par semaine) ;
- ménager un réacteur de désinfection en aval ;
- pratiquer (éventuellement) une injection de chlore en amont des réacteurs, ou en cours de lavage.
contrôle des installations
La filière de reminéralisation « CO2–calcaire marin » présente un gros avantage par rapport à la filière « CO2–chaux » : elle n’est tributaire que d’un dosage de CO2 (pas toujours nécessaire) et on ne risque aucun surdosage pouvant entraîner la production d’une eau fortement entartrante.
Elle est donc particulièrement adaptée pour les petites unités alimentées en eau de forage et dont le débit est souvent variable.



limites du procédé
Les eaux de forage peuvent contenir des ions métalliques dissous (Fe2+, Mn2+) qui peuvent précipiter au contact de l’atmosphère et à la suite d’une élévation de pH. Les hydroxydes ou oxydes formés viennent obturer les pores du matériau et retardent sa dissolution.
Il peut en être de même avec des eaux colorées fortement chargées en acides humiques : ceux-ci peuvent précipiter sous la forme de complexes métalliques ou de sels de calcium qui provoquent les mêmes problèmes.
Dans ces cas un traitement préalable du fer ou du manganèse par voie physicochimique ou biologique (voir élimination du fer et élimination du manganèse), ou la coagulation des acides humiques par un sel de fer suivi d’au minimum une filtration sur sable, est requis avant la reminéralisation.
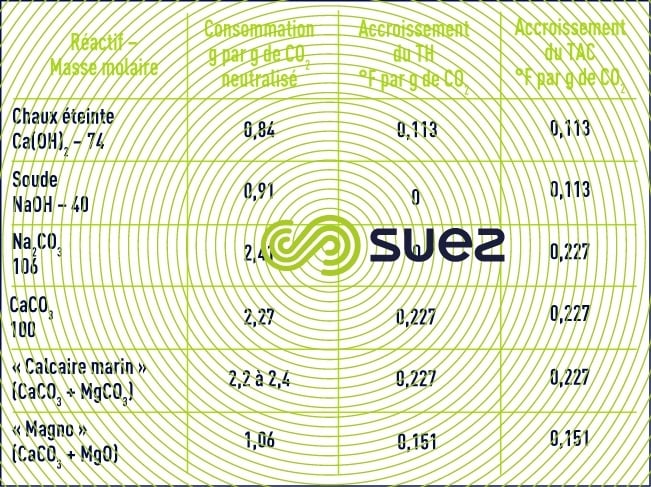
consommations de réactifs
Le tableau 12 regroupe les consommations des différents réactifs considérés comme purs, ainsi que leur action sur la minéralisation des eaux.


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













