réactions cathodiques et coorosivité de l'eau
Temps de lecture :corrosion du fer en l’absence d’oxygène
La notion de noblesse pour définir la tendance d’un métal à la corrosion ne s’applique que dans l’eau pure à 25 °C. Pour être complète, la définition de la tendance des métaux à la corrosion dans l’eau doit tenir compte de l’ensemble des caractéristiques de l’eau. À titre d’exemple, on peut citer le cas du fer exposé à une masse d’eau pure captive en l’absence d’oxygène dissous à 25 °C.
Dans ces conditions, la réaction anodique pour le fer est la suivante :

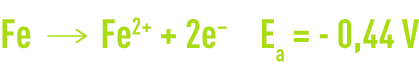
La réaction cathodique est la réduction des ions hydrogène pour former de l’hydrogène gazeux:

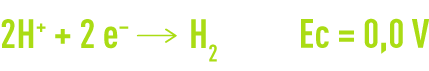
La réaction globale de corrosion s’exprime donc comme suit :

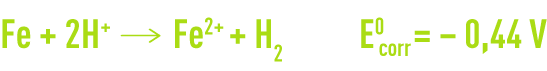
Pour ce système, la relation de Nernst est la suivante :

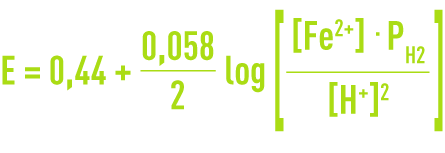
où PH2 est la pression partielle de l’hydrogène gazeux, fixée à 1 dans cet exemple.
Au fur et à mesure que se déroule la réaction, un courant électrique circule entre les deux demi-cellules, provoquant un appauvrissement en H+ et une accumulation de Fe2+. La réaction se poursuit jusqu’à ce que soient atteintes des concentrations en ions Fe2+ et H+ qui amènent le potentiel E à la valeur 0,0 volt, point auquel le système a atteint l’équilibre. Ceci se produit à peu près dans les conditions suivantes, en supposant qu’il n’y a pas de perte de Fe2+ ou de H+ :

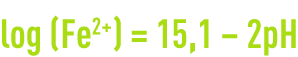
Il n’y a aucun domaine pratique de stabilité commun au fer et à l’eau au-dessous de pH 10,5, pH auquel la solubilité du fer est 10–6 mol·kg–1, valeur correspondant à une corrosion négligeable.
À un pH inférieur, le fer ferreux restant soluble, aucun dépôt n’est formé, aussi une corrosion lente et généralisée perdure, résultat de la présence d’une infinité de cathodes et d’anodes coexistantes et occupant toute la surface du métal.
corrosion du fer en présence d’oxygène dissous
mécanisme électrochimique
L’oxygène dissous joue un rôle majeur et complexe dans le mécanisme de la corrosion, en particulier dans le cas du fer. L’oxygène participe à la réaction cathodique de demi-cellule selon la réaction suivante :


Le potentiel de la réaction cathodique de demi-cellule est alors déterminé par la relation de Nernst :

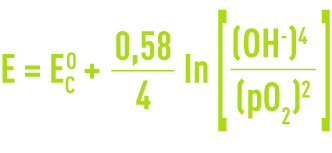
Les facteurs affectant le potentiel cathodique sont donc :
- la concentration en ions OH–, elle-même déterminée par le pH ;
- la pression partielle d’oxygène pO2.
Lorsque ce potentiel est supérieur à celui de l’électrode métallique, le potentiel net de la réaction de corrosion est positif, et la réaction se poursuit. Dans les conditions normales, le potentiel de la réaction est + 1,21 volt, signe que l’eau aérée a une forte réactivité thermodynamique vis-à-vis du fer.
rôle des produits de corrosion
Les produits des réactions anodique et cathodique de demi-cellule sont respectivement des ions Fe2+ et OH–. Les réactions de ces espèces avec l’oxygène et les autres composés de l’eau jouent un rôle crucial dans la formation soit de couches de protection soit de dépôts nocifs.
L’oxygène dissous participe à des réactions secondaires formant des produits de corrosion au niveau de l’anode :

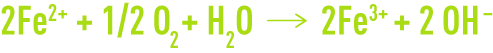
La solubilité des espèces contenant des ions Fe3+ est beaucoup faible que celle des composés Fe2+, leur dépôt va freiner la corrosion expliquant le rôle essentiel de l’oxygène dans de nombreux mécanismes d’inhibition de corrosion.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












