cinétique des réactions de corrosion
Temps de lecture :La distinction entre immunité et corrosion est définie par le potentiel électrochimique de la réaction de corrosion (voir ci-dessus). Cependant, la définition de la passivation implique l’étude de la cinétique des réactions électrochimiques et le concept de polarisation, c’est-à-dire la variation des potentiels de l’électrode résultant d’un courant net. La relation entre la vitesse de réaction de demi-cellule et son potentiel observé a la forme générale suivante :


où, pour une réaction électrochimique, E est le potentiel observé, E0 le potentiel thermodynamique et la vitesse de réaction est définie par le flux d’électrons (i) entre la cathode et l’anode.
L’impact de la polarisation sur un processus de corrosion peut être schématisé par un diagramme d’Evans, comme indiqué en figure 2.

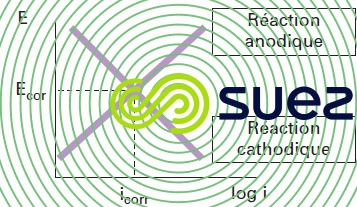

Le potentiel (représenté par l’axe des ordonnées) est le potentiel réellement appliqué alors que le sens du courant produit par les réactions anodique et cathodique est opposé. Le diagramme d’Evans représente la valeur absolue du courant de demi-cellule. Ainsi, les besoins de l’électroneutralité sont satisfaits au point d’intersection des lignes des réactions anodique et cathodique. Le potentiel (Ecorr) et le courant (Icorr) à ce point définissent le potentiel de corrosion et le courant/vitesse du mécanisme électrochimique global.
Si la réaction cathodique est polarisée, la branche cathodique du diagramme d’Evans est déplacée vers des valeurs de courant plus basses à un potentiel constant b → c. L’effet net est visible sur la figure 3.

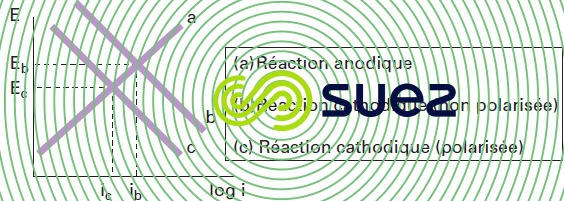

Le résultat observable de la polarisation cathodique, est donc qu’à la fois le courant de corrosion (icorr) et le potentiel de corrosion (Ecorr) sont réduits. De même, si un système se corrodant subit une polarisation anodique, la branche anodique du diagramme d’Evans est déplacée vers des valeurs plus basses a -> b conduisant à une réduction du courant de corrosion mais une augmentation du potentiel de corrosion (figure 4).



Les principes sont à la base de la classification expérimentale des processus d’inhibition de la corrosion « anodiques » ou « cathodiques » suivant le type de polarisation observé.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












