réactions anodiques et tendances à la corrosion
Temps de lecture :Pour un ensemble de conditions données, le potentiel est représenté par la relation de Nernst (voir oxydoréduction et principes de base - définitions de l'électrolyse). La relation de Nernst appliquée à la corrosion anodique à 25 °C s’exprime comme suit :

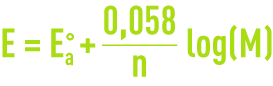
dans laquelle :
Eao = potentiel normal de la réaction anodique ;
M= activité de l’ion métallique dans la solution.
Le tableau 15 du chapitre Processus élémentaires du génie physico-chimique en traitement de l'eau définit le classement des potentiels normaux de plusieurs métaux suivant leur potentiel hydrogène normal. Les métaux ayant un potentiel normal positif sont dits « nobles » et sont moins prédisposés à la corrosion. Les métaux ayant un potentiel normal moins élevé sont moins nobles. Les métaux ayant un potentiel normal négatif sont thermodynamiquement instables en présence d’eau pure à un pH de 7,0 et une température de 25 °C. On peut citer le fer, qui a un potentiel normal de – 0,44 volt donc non noble, et le cuivre avec un potentiel de + 0,34 volt donc noble.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












