causes chimiques
Temps de lecture :Elles sont liées à la composition des ciments et à la corrosivité des eaux en contact.
La composition des ciments est à base principalement de silice, de chaux, d’alumine formant divers silicates, et secondairement de fer, de magnésie et d’alcalins. Elle définit un milieu généralement très basique qui comporte une réserve élevée de sels solubilisables.
Lors de la prise du ciment, du Portland en particulier, il y a libération importante de chaux, sous forme de Ca(OH)2, et formation d’aluminate tricalcique, de symbole « C3A ».
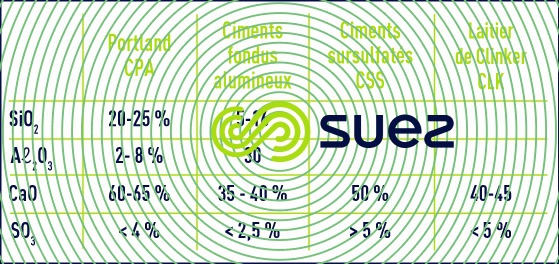
Le tableau 9 donne les teneurs des constituants principaux de divers ciments.


La dégradation chimique peut être due à :
- l’agressivité du CO2 « libre » ;
- l’attaque par acidité forte ;
- l’action de l’ammonium ;
- l’action des sulfates ;
- l’attaque par alcalinité forte ;
- la corrosion bactérienne avec formation de H2S.
agressivité carbonique : cas des eaux douces
L’attaque des ouvrages par le dioxyde de carbone a lieu en présence d’eaux douces ou dès que la teneur du CO2 en excès dépasse 15 mg · L–1.
Toutefois, cette attaque reste superficielle et ne met pas en danger la pérennité des ouvrages. En effet, les bicarbonates produits par l’action du CO2 sur la chaux du béton (portlandite) vont à leur tour se combiner à la chaux pour donner du carbonate de calcium qui augmente la compacité du béton et ralentit la dégradation.
Pour éviter la dégradation des couches superficielles, il est recommandé de ne pas utiliser de ciments CPA, mais des Portlands composés (CPJ) ou des CLC ou encore des ciments de haut-fourneau (CHF ou CLK). Les autres recommandations sont :
- augmenter les épaisseurs d’enrobage des aciers ;
- prévoir un enduit au mortier de ciment de 2 ou 3 cm d’épaisseur ;
- proscrire les lavages abrasifs tels que les nettoyeurs à pression.
attaque par acidité forte
Cette attaque est d’autant plus grave que les sels de calcium formés sont plus solubles. Une corrosivité croissante est rencontrée en présence des acides suivants : phosphorique, sulfurique, nitrique, chlorhydrique. Les acides organiques sont également nocifs, particulièrement dans les effluents de laiterie ou de fabrication de jus de fruits.
Dans le cas d’acidité modérée, on améliore la résistance de la corrosion en abaissant le rapport eau/ciment et/ou en utilisant des ciments alumineux (de mise en œuvre d’ailleurs plus délicate). Ceci est valable pour des pH supérieurs à 2 et avec certaines précautions.
Mais d’une façon générale, il y a souvent risque de fissuration des ouvrages, dont la protection totale ne peut jamais être assurée que par un revêtement correct. Par ailleurs, plusieurs législations relatives au déversement des eaux résiduaires préconisent de maintenir le pH de l’eau qui circule au contact des parois entre 4,5 (ou 5,5) et 9,5.
action de l’ammonium
La présence d’ammonium dans les eaux résiduaires peut intervenir dans les processus de destruction du béton de deux façons :
- par développement de réactions biologiques nitrifiantes, et donc acidifiantes, qui ne peuvent toutefois se développer qu’en milieu aérobie, comme par exemple dans les réfrigérants atmosphériques ;
- par dégagement de l’ammoniac déplacé par la chaux qui accélère la solubilisation de celle-ci et provoque la dégradation du ciment.
Les sels de magnésium peuvent donner lieu au même processus (formation de Brucite : MgO, H2O). Les concentrations trop élevées en NH4 et en Mg sont donc à éviter, tout particulièrement lorsqu’il y a également présence de sulfates.
action des sulfates
Cette action est complexe :
- sulfatation de la chaux libre du ciment produisant du gypse ;
- transformation des aluminates tricalciques en Ettringite très expansive (facteur 2 à 2,5) :

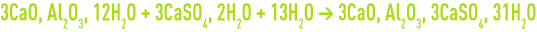
En présence de magnésie, la décomposition des silicates alcalins du ciment peut également s’ajouter aux deux mécanismes précédents.
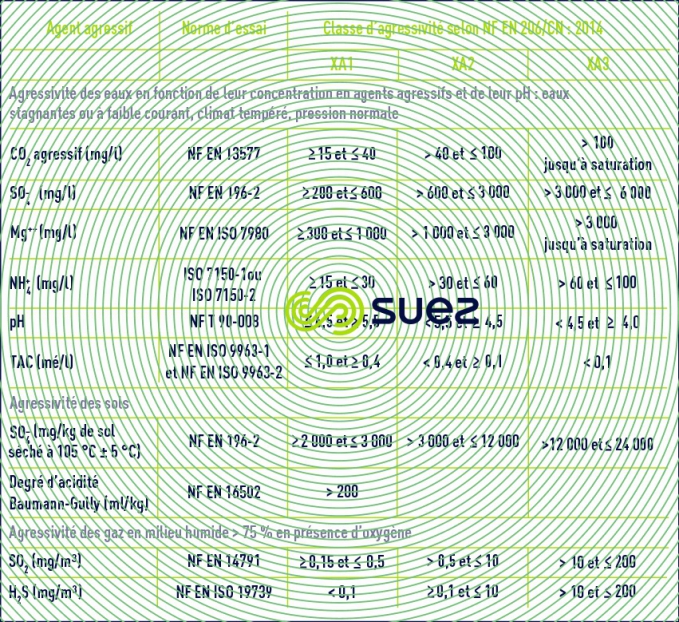
La norme AFNOR FD P 18-011 définit des classes d’agressivité des eaux salines vis-à-vis des bétons classiques (tableau 10) ainsi que le principe des mesures de protection.
Dans le cas d’eaux très fortement agressives (XA3), le recours à un revêtement est conseillé, tandis que, dans le cas des eaux fortement agressives, l’emploi de ciment à base de laitier présentant un indice d’hydraulicité élevé peut être envisagé, si par ailleurs d’autres paramètres chimiques de l’eau ne sont pas à prendre en compte.
Exemples :
- ciment de laitier au clinker (CLK) à base de 80 % de laitier granulé ;
- ciment de haut fourneau (CHF) à 60-75 % de laitier.
En présence d’eau de mer on dispose aussi de différents ciments qui présentent des teneurs faibles en « C3A ».


attaque par bases fortes (NaOH, KOH, Na2CO3)
Elle est nocive vis-à-vis de tous les ciments, en raison du risque de solubilisation de certains constituants à base d’alumine ; on conseille, en l’absence de revêtement, de ne pas admettre d’eaux de pH supérieur à 12 au contact de ciments.
corrosion bactérienne avec formation de H2S
Cette corrosion se rencontre dans le transfert des eaux résiduaires urbaines. Le principe du mécanisme de la corrosion en milieu anaérobie a déjà été décrit, mais alors que, dans les circuits de refroidissement, ce processus suit et amplifie une corrosion chimique préalable, dans le cas d’eaux vannes ou d’eaux très sales, il provient généralement de la fermentation anaérobie des matières déposées et comporte deux phases :
- formation et libération de H2S ;
- oxydation de H2S. en présence d’air et formation de H2SO4.
Ces réactions sont accélérées dès que le pH descend au-dessous de 6 et sont d’autant plus rapides que les eaux sont plus chaudes.
En égout, l’attaque s’effectue au-dessus de l’interface eau/air en raison du dégazage et de la condensation de l’eau. L’apport d’oxydant (H2O2), de précipitant (Fe2+) ou de nitrate évite plus ou moins totalement cette formation de H2S.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












