principaux adsorbants
Temps de lecture :charbon actif
Le charbon actif est le résultat d’un traitement thermique en atmosphère strictement contrôlée : l’activation thermique (séchage, carbonisation à 500-600 °C et oxydation ménagée à 850-1 000 °C) de divers matériaux naturels (houille, lignite, bois…).
Ce traitement ne laisse que le squelette carboné des matériaux et le départ des produits volatils y laisse tout un réseau de pores (figure 71) qui explique les fortes surfaces développées. Toutefois la taille des pores et leur structure varient suivant l’origine du charbon et le traitement d’activation reçu, ce qui explique les propriétés différentes des charbons actifs obtenus (capacité, friabilité), à noter que le problème de friabilité peut être résolu en fabriquant des charbons en grains reconstitués (ex. filés sous forme de cylindres de quelques mm).



L’expérience montre que les « bons » charbons actifs sont des adsorbants à très large spectre : la plupart des molécules organiques se fixent à leur surface, les plus mal retenues étant les molécules les plus polaires et celles linéaires de très faible masse molaire (alcools simples, premiers acides organiques…). Les molécules peu polaires génératrices de goût et d’odeur, les molécules à relativement haute masse molaire sont, pour des raisons différentes, bien adsorbées sur les charbons.
Outre ces propriétés adsorbantes, les charbons actifs sont également d’excellents supports de bactéries capable de dégrader la fraction biodégradable de la phase adsorbée (voir le concept de CAB (charbon actif biologique)). Ainsi une partie du support peut être régénérée biologiquement.
Ils ont également des propriétés réductrices vis-à-vis des oxydants.
principales applications
Les charbons actifs sont employés :
- en traitement d’affinage des eaux potables ou des eaux industrielles de haute pureté ; le charbon actif fixe alors les composés organiques dissous qui ont échappé à la dégradation biologique naturelle (autoépuration des cours d’eau), puis aux traitements physico-chimiques amont. En fait, ils ont tout d’abord été utilisés pour améliorer les qualités organoleptiques d’une eau en éliminant les matières organiques responsables de goûts, d’odeurs et de couleur. Avec l’accroissement de la pollution, leur emploi s’est étendu à l’élimination de nombreux polluants et micropolluants tels que les phénols, les hydrocarbures, les pesticides, les détergents et même certains métaux lourds qui ne sont pas totalement éliminés par la clarification. Ils participent également à l’élimination des précurseurs de THM et des sous-produits de désinfection ;
- en traitement d’eaux résiduaires industrielles, lorsque l’effluent n’est pas biodégradable ou lorsqu’il contient des éléments toxiques organiques interdisant l’emploi de techniques biologiques. Dans ce cas l’emploi de charbon actif peut permettre de retenir sélectivement les éléments toxiques et, par suite, de retrouver un effluent normalement biodégradable ;
- en traitement « tertiaire » des eaux résiduaires ou industrielles. Le charbon fixe les composés organiques dissous, réfractaires au traitement biologique situé en amont, et permet ainsi d’éliminer une plus ou moins grande proportion de la DCO résiduelle (DCO « dure ») ;
- pour réduire les oxydants
Une propriété des charbons actifs est leur action réductrice des oxydants (chlore, dioxyde de chlore, permanganate, chloramines, ozone…).
On réalise ainsi la déchloration d’une eau ayant subi un traitement de chloration par excès selon les réactions suivantes :

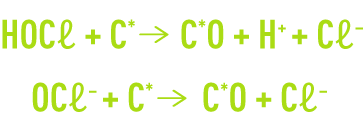
où C* et C*O représentent respectivement la surface vierge et la surface oxydée du charbon actif. Ces réactions peuvent se poursuivre par la formation de CO2, d’où une certaine consommation de charbon qu’il faut donc parfois compenser par une recharge partielle.
On caractérise cette action déchlorante par la longueur de demi-déchloration : c’est la hauteur de lit filtrant qui, à une vitesse donnée, provoque une diminution de moitié de la concentration de chlore dans l’eau (voir étude du pouvoir adsorbant d'un charbon). Le pH influence cette longueur.
En pratique on utilise, suivant la température, la teneur en chlore libre et la tolérance admise sur le chlore résiduel, des charges volumiques allant de 5 à 15 volumes d’eau par volume de charbon actif et par heure.
Cette action réductrice existe aussi vis-à-vis des chloramines qui sont décomposées en azote et acide chlorhydrique. Toutefois, la cinétique est plus lente que dans le cas du chlore libre (longueur de demi-déchloration beaucoup plus élevée) ; il faut donc diminuer nettement les charges volumiques si l’on veut obtenir des résultats comparables.
Cette action est mise en œuvre pour supprimer, lorsque nécessaire, les résiduels de réactifs : ozone, (odeur, corrosion), permanganate (coloration).
Le pouvoir déchlorant d’un charbon est perturbé par tout ce qui gêne le contact entre le charbon et l’eau à traiter : dépôts de carbonate de calcium, saturation de la surface par adsorption de polluants divers…
Réciproquement, cette oxydation de la surface du charbon se traduit par une diminution de l’efficacité d’adsorption vis-à-vis des polluants les moins facilement adsorbables.
autres adsorbants
En plus des adsorbants naturels déjà mentionnés, de nouveaux adsorbants sont développés :
- Adsorbants minéraux : les alumines et oxydes métalliques divers ; bien que présentant pour certains des surfaces spécifiques importantes (300 à 400 m2.g–1) ces solides adsorbent plus sélectivement que les charbons. Leur capacité dépend étroitement du pH et de leur mésoporosité. En dessous du point isoélectrique, seules les molécules chargées négativement sont adsorbées sur les sites positifs. Dans l’état actuel de leur développement ils ne peuvent être compétitifs vis-à-vis du charbon actif pour l’adsorption des MO de l’eau. Toutefois certains de ces solides, comme les alumines ou les oxyhydroxydes ferriques, voire ces deniers chargés d’oxyde de manganèse, présentent un réel intérêt pour l’élimination de l’arsenic, du fluor, des phosphates ;
- Adsorbants organiques : résines macromoléculaires à surfaces spécifiques comprises entre 300 et 750 m2·g–1; leurs capacités sont très médiocres par rapport à celles des charbons actifs, en revanche, ces résines ont une meilleure cinétique d’adsorption (utilisation entre 5 et 10 vol · vol–1·h–1) et sont souvent plus faciles à régénérer (énergie de liaison faible).
On peut également mentionner les « scavengers », résines macroporeuses anioniques (voir principaux types d'échangeurs d'ions). Toutefois, ces résines ont une moindre surface spécifique et doivent en partie leur activité vis-à-vis des substances polaires (telles que : acides humiques, détergents anioniques) à leur charge ionique, ce qui les distingue des autres adsorbants.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.













