inhibitions de la précipitation
Temps de lecture :La précipitation chimique peut être ralentie, voire bloquée, par certains composés présents dans les eaux. C’est l’inhibition spontanée qui est gênante si cette précipitation est souhaitée.
Si au contraire, celle-ci doit être évitée, l’inhibition peut être provoquée par l’ajout d’inhibiteurs.
Ces composés organiques agissent soit en formant des « complexes » relativement solubles avec les ions à précipiter, soit en dispersant les produits de la précipitation.
inhibition spontanée : exemples
en décarbonatation
- aux pH élevés de décarbonatation NH4 est déplacé en NH4OH, ce qui augmente donc la valeur du TAC résiduel ;
- certains acides organiques, humiques ou fulviques, forment avec le calcium des complexes solubles qui augmentent la dureté résiduelle ;
- dans le cas d’eaux de surface polluées par des effluents urbains, la présence de polyphosphates (agents séquestrants) ralentit la vitesse de germination et de croissance des cristaux et provoque en conséquence leur dispersion sous forme colloïdale.
en traitement deaux résiduaires industrielles
Telles celles de lavage de gaz, la présence simultanée de cations métalliques (Ni2+, Zn2+ …) et de NH4+ détermine la formation de complexes métallo-ammoniacaux relativement stables.
en déferrisation physico-chimique
La présence de silice augmente la teneur en fer résiduel, sous forme d’un complexe fer-silice (voir traitement des eaux potables).
inhibition provoquée
propriétés principales
Les produits utilisés peuvent avoir différentes actions.
inhibition de la cristallisation
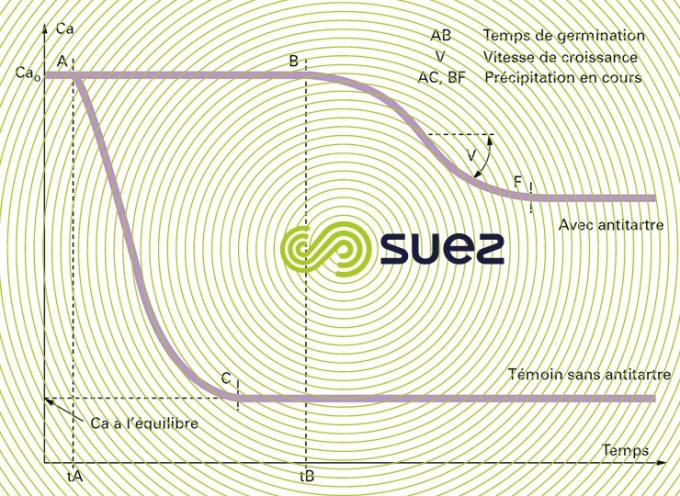
Sur des solutions sursaturées, l’addition de faibles doses d’inhibiteurs de l’ordre du mg · L–1 allonge le temps de germination et ralentissement de la croissance des germes (figure 10) : c’est l’effet de seuil.


distorsion du réseau cristallin
Action sur la vitesse de croissance en modifiant le faciès de la variété allotropique du précipité qui présente moins de risques d’adhérence sur les parois et donc d’entartrage.
pouvoir dispersant
Aptitude à maintenir en suspension à l’état divisé des particules solides qui auraient tendance à s’agglomérer. Elle est due à l’adsorption de polymère sur les particules ou à l’action sur leurs charges électriques (renforcement de leur pH).
Certains produits, utilisés à forte dose, ont la capacité de remettre en solution ou en suspension des sels déjà précipités sur les parois (nettoyage partiel ou aide au détartrage).
pouvoir complexant (ou séquestrant)
Propriété d’intégrer dans leur molécule des anions ou des cations pour former, malgré la présence d’un agent précipitant, de nouveaux composés solubles stables.
La complexation nécessite de grandes quantités de produit.
principaux composés
les complexants ou chélatants
Tels l’EDTA (acide éthylène-diaminetétracétique) et ses sels de sodium

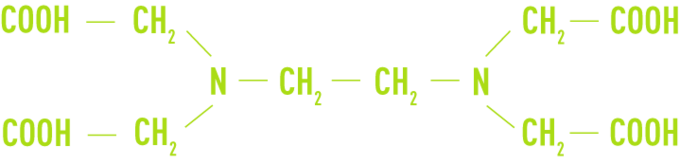
Ils ont été utilisés surtout dans les eaux de chaudière contenant des traces de dureté, ou lors d’opération de détartrage, mais leur mise en œuvre est délicate.
Pour des raisons économiques, on utilise plutôt « l’effet de seuil » dans les traitements préventifs, en particulier dans les circuits de refroidissement, en faisant appel aux autres familles.
les polyphosphates
Ils constituent la famille la plus connue.
Les polyphosphates proprement dits ont une structure linéaire et pour formule générale Mn+2Pn,O3n+1 Les premiers termes de la série des sels de sodium sont le pyrophosphate : Na4P2O7 puis le tripolyphosphate, Na4P2O7, NaPO3 ou Na5P3O10.
Les polymétaphosphates ont une structure cyclique et répondent à la formule générale (MPO3)n Les termes les plus connus sont le trimétaphosphate (NaPO3)3 et l’hexamétaphosphate (NaPO3)6. Les produits commerciaux vendus sous ces appellations sont souvent des mélanges dont le préfixe représente le degré de condensation moyen.
L’action retardatrice est franche vis-à-vis du carbonate de calcium, un peu moins vis-à-vis de la magnésie et du sulfate de calcium.
Habituellement, pour stabiliser une eau ayant des TH et TAC de l’ordre de 20 °F, on utilise environ 2 g · m–3 de polyphosphate. Cette dose augmente avec le TH, le TAC, la turbidité et la température d’utilisation. La réglementation française pour l’eau potable impose un maximum de 5 g · m–3 de polyphosphate, exprimé en P2O5.
Les polyphosphates sont offerts sur le marché sous trois formes principales :
- les polyphosphates cristallins, aisément solubles ;
- les polyphosphates « vitreux » ;
- les polyphosphates liquides.
Les polyphosphates se décomposent progressivement par hydrolyse en donnant naissance à des ions orthophosphates PO43– : la vitesse d’hydrolyse augmente avec la température et l’acidité du milieu, sans que l’on puisse parler d’un seuil précis au-delà duquel les polyphosphates sont détruits. Leur efficacité antitartre devient aléatoire au-delà de 60 °C. À température élevée, en présence de calcium, il y a même risque de formation de phosphate tricalcique très peu soluble.
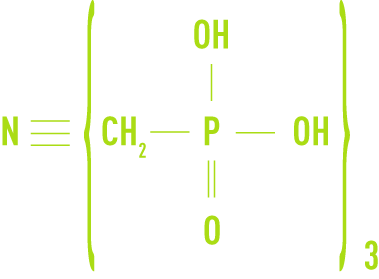
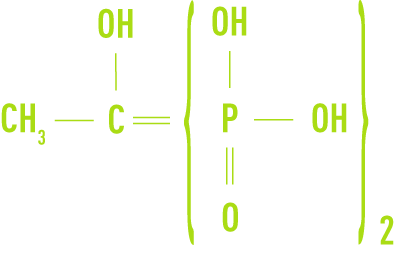
Les dérivés organiques du phosphore Les plus connus sont les phosphonates, largement utilisés dans les circuits de refroidissement. On en distingue deux types principaux :
- l’AMP, acide amino-tri méthylène-phosphonique

- l’HEDP, acide hydroxyéthane diphosphonique

Ces composés sont en général commercialisés sous forme de solutions concentrées. Ils sont stables bien au-delà de 100 °C mais sensibles à la présence de chlore libre. Non toxiques, leur emploi en eau potable est cependant subordonné à l’agrément des autorités compétentes.
Les doses d’emploi varient d’abord avec les caractéristiques et conditions d’utilisation de l’eau, mais aussi d’un produit commercial à l’autre. En moyenne, elles sont de l’ordre de 1 g ·m–3 en P2O5, soit environ 10 g · m–3 en produit commercial.
La liaison P-C-P plus stable que la liaison P-O-P permet de les utiliser à des températures élevées supérieures à 130 °C comme dans les évaporateurs.
les polymères organiques de synthèse
Plus récents, ils ont un grand développement dans le conditionnement des eaux, avec comme familles principales :
Type acrylique ou méthacrylique

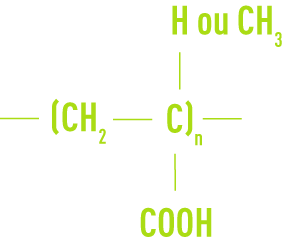
Type maléique

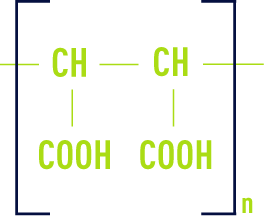
Les polymères sont des mélanges de molécules de différentes tailles. La définition d’un polymère passe par la connaissance de sa masse molaire et de la répartition des masses molaires.
Quelques propriétés à signaler :
- un caractère anionique ;
- des poids moléculaires voisins de 103 pour les antitartres dispersants, 104 pour les dispersants ;
- un meilleur pouvoir dispersant que les polyphosphates et les phosphonates ;
- bonne stabilité à la température (jusqu’à 150 °C) et au chlore ;
- facilement biodégradables après leur rejet.
Les formulations comportent souvent des copolymères ou des terpolymères pour en renforcer l’efficacité selon l’application recherchée.
autres dispersants
Les naphtalène et polystyrène sulfonates présentent un caractère anionique et peuvent être associés aux polyphosphates et aux phosphonates.
Le tanate de sodium, dérivé du bois, est encore utilisé dans les chaudières BP et MP à une dose de 2 g · m–3 par °F de calcium.
Pour ceux recherchant une connaissance plus approfondie des mécanismes de l’entartrage et de l’action des produits antitartre, vous pouvez consulter le mémento de SUEZ Water Technologies & Solutions dédié au traitement des eaux industrielles.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












