les réducteurs
Temps de lecture :Les traitements par réduction physico-chimique répondent à des objectifs très spécifiques tels que :
- l’élimination de l’oxygène ;
- la réduction du chrome hexavalent ;
- la réduction des nitrites ;
- la destruction des oxydants résiduels.
réduction chimique de l’oxygène
On emploie du sulfite de sodium ou du bisulfite d’ammonium qui, bien que plus cher, est de mise en œuvre plus simple et présente un effet tampon plus large.



Trois applications sont fréquentes : traitement des eaux de chaudières, conditionnement de circuits fermés de refroidissement et conditionnement des eaux en récupération secondaire (champs pétrolifères).
réduction du chrome hexavalent
Le chrome est surtout présent dans les ERI à l’état trivalent ou hexavalent. L’élimination du chrome total par voie chimique se déroule en deux étapes : réduction du chrome hexavalent en chrome trivalent, précipitation du chrome trivalent sous forme d’hydroxyde. Les formes courantes du chrome hexavalent sont l’ion chromate CrO42–, l’ion dichromate Cr2O72– et l’acide chromique H2CrO4.
Le tableau 42 détaille les différentes voies de réduction avec les quantités théoriques de réactifs purs qui s’y rapportent. La technique la plus employée met en jeu le bisulfite de sodium.
réduction des oxydants résiduels
Le résiduel d’oxydant doit dans certains cas être réduit ou totalement éliminé :
- en préparation d’eau de boisson ou après désinfection d’ERU pour limiter la formation ultérieure de sous-produits indésirables ;
- avant passage sur membrane ou sur résine échangeuse d’ions ;
- après transport d’eau potable sur une longue distance ;
- avant rejet ou recyclage du gaz dans le cas d’utilisation d’ozone



élimination du chlore résiduel
Les agents les plus fréquemment utilisés sont le dioxyde de soufre (gaz fourni sous forme liquéfiée) et le bisulfite de sodium (disponible en solution aqueuse à 23-24 % en SO2) qui agissent selon les réactions suivantes :

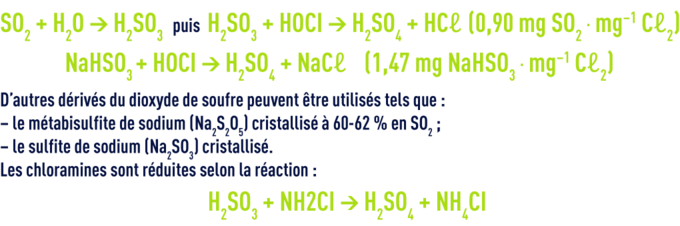
Les réactions sont rapides de sorte qu’en distribution d’eau potable, le temps de contact disponible en canalisation est suffisant. Le dosage du réducteur est régulé par asservissement au résiduel de chlore.
Devant osmose inverse, un léger excès de réactif est couramment utilisé (environ 20 %) par rapport à la stœchiométrie.
Remarque : Devant osmose inverse, le thiosulfate de sodium (Na2S2O3) ne doit pas être utilisé, car il présente un risque de formation de soufre minéral (conduisant au colmatage des modules) par une réaction secondaire de décomposition du thiosulfate (dismutation).
Dans le cas des eaux de chaudière, le Traitement et conditionnement des eaux industrielles décrit les conditions des traitements physique et chimique (nature des réactifs) utilisés. Dans les IAA, on utilise généralement du sulfite pur anhydre (ou exceptionnellement de l’acide ascorbique).
Le charbon actif peut être utilisé en déchloration. Les temps de contact dans les colonnes sont de l’ordre de quelques minutes (voir principaux adsorbants). Cette technique est utilisée principalement dans l’industrie de préparation des boissons ou devant les chaînes de déminéralisation Elle est à déconseiller avant osmose inverse : risque de prolifération bactérienne, relargage de fines.
élimination de l’ozone résiduel
L’ozone résiduel dans le gaz à l’évent d’un réacteur d’ozonation est décomposé selon trois principales techniques :
- destruction thermique par chauffage à 300-350 °C pendant 2 à 4 s ;
- destruction par combustion du charbon actif
La réaction 2 O3 + 3C → 3 CO2 implique une consommation de 0,38 g de charbon par g d’ozone détruit. Elle est généralement conduite en lit de charbon actif porté à 60 – 80 °C pour assurer un rendement élevé. Au cours de la réaction, les particules de charbon actif sont réduites à l’état pulvérulent ; des risques d’explosion apparaissent alors mais sont contrôlés par humidification ;
- destruction catalytique
De nombreux catalyseurs sont aptes à décomposer l’ozone. Les formulations les plus classiques correspondent au dioxyde de manganèse et au palladium déposé sur alumine. Les catalyseurs fonctionnent à une température entre 50 et 70 °C pour éviter l’inactivation due à la condensation de l’eau contenue dans le gaz à traiter.
Des techniques alternatives existent mais nécessitent des temps de contact plus longs qui limitent leur application :
- destruction photochimique par irradiation UV à longueur d’onde égale à 254 nm pendant quelques minutes ;
- décomposition chimique en tour de lavage à l’aide de sulfate ferreux, de chlorite de sodium, de peroxyde d’hydrogène…
Sur les mêmes principes, si la décomposition naturelle de l’ozone résiduel en phase liquide n’est pas suffisamment rapide, différents agents peuvent être mis en œuvre :
- charbon actif ;
- anthracite ;
- UV ;
- bisulfite ;
- iodure ou bromure qui produisent alors de l’iode ou du brome libre capables d’agir comme désinfectant notamment en traitement d’eaux de piscines.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












