notions fondamentales sur la réaction chimique d'oxydo-réduction
Temps de lecture :réaction doxydoréduction et couple redox
Chaque réaction d’oxydoréduction peut être décrite à partir des demi-équations relatives aux deux couples redox impliqués de telle sorte que les électrons cédés par le réducteur 2 soient transférés à l’oxydant 1.


Le nombre d’électrons captés par Ox1 doit être égal au nombre d’électrons libérés par Red2 de sorte que la réaction globale est obtenue en combinant terme à terme les deux équations partielles multipliées chacune par le nombre d’électrons impliqués dans l’autre. Par exemple, l’oxydation de l’ion ferreux par le permanganate en milieu acide s’écrit :

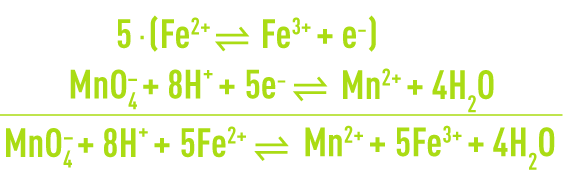
prévisions des réactions doxydoréduction
Le sens de déplacement de l’équilibre dépend de la force relative des couples redox Ox1/Red1 et Ox2/Red2. La force de chaque couple redox est donné par le potentiel standard noté E° et défini par rapport au couple de référence H3O+/H2 à pH égal à 0 et à la température T.

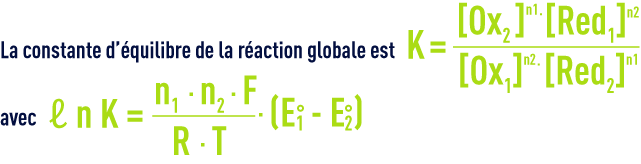
Ainsi, pour que la réaction se produise vers la droite, il faut K > 1 c’est-à-dire que l’oxydant 1 et le réducteur 2 doivent être respectivement plus forts que l’oxydant 2 et le réducteur 1, ce qui équivaut à un potentiel standard plus élevé pour le couple 1 par rapport au couple 2 : E1° > E2°.
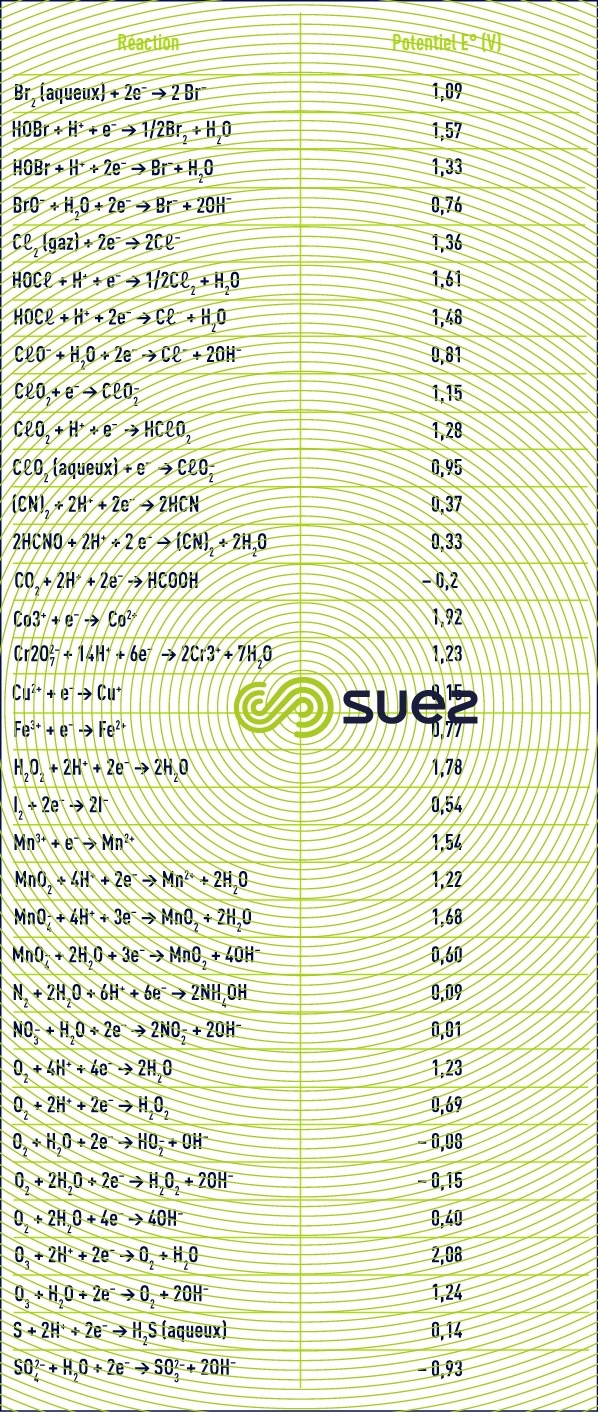
Les valeurs du potentiel standard normal (T = 298 K) de certains couples de composés rencontrés dans l’eau sont donnés dans le tableau 23 complémentaire du tableau 15 (voir principes de base - définitions).


degré ou nombre d'oxydation
S’il est facile de repérer l’espèce la plus oxydée dans les couples d’élément métallique comme Fe3+/Fe2+, cette distinction est en revanche plus délicate entre divers composés plus complexes d’un même élément comme dans la série ion chlorure (Cℓ–), chlore (Cℓ2), ion hypochlorite (CℓO–), ion chlorite (CℓO2–), ion chlorate (CℓO3–) et ion perchlorate (CℓO4–). On utilise alors le degré d’oxydation ou nombre d’oxydation (noté NO) relatif à un atome donné qui correspond au nombre d’électrons mis en jeu pour former le composé moléculaire ou ionique à partir du corps pur en considérant que toutes les liaisons de l’élément dans le composé sont ioniques. Le nombre d’oxydation est positif si la transformation est une oxydation et négatif si une réduction est nécessaire. Il est représenté par un chiffre romain pour le différencier de la charge ionique. Il est déterminé en appliquant les règles suivantes :
- tout élément à l’état de corps pur a pour nombre d’oxydation 0 ;
- dans une molécule, la somme des nombres d’oxydation des éléments constitutifs pondérés de leur nombre est égale à 0 ;
- dans une espèce ionique, la somme des nombres d’oxydation des éléments constitutifs pondérés de leur nombre est égale à la charge de l’ion ;
- le nombre d’oxydation de l’hydrogène est + I (sauf dans les hydrures pour lesquels, NO(H) = – I) ;
- le nombre d’oxydation de l’oxygène est – II (sauf dans le cas des peroxydes où NO(O) = – I).
Dans la série des composés du chlore, le nombre d’oxydation du chlore vaut alors – I pour Cℓ–, 0 pour Cℓ2, + I pour CℓO–, + III pour CℓO2–, + V pour CℓO3– et + VII pour CℓO4–. L’élément est d’autant plus oxydé que son nombre d’oxydation est élevé.
Le calcul des degrés d’oxydation est particulièrement indiqué lorsque les équations partielles d’oxydoréduction ne sont pas connues comme pour la plupart des composés organiques. Il permet en effet d’établir l’équation globale sur les principes de conservation du nombre d’oxydation et de la matière. En reprenant le cas de la réaction de l’ion ferreux avec le permanganate en milieu acide :

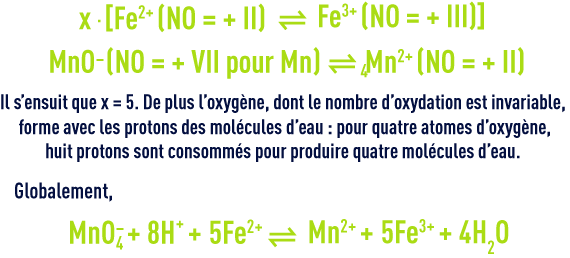
variation du potentiel d'oxydoréduction en fonction du pH
Certaines réactions partielles d’oxydoréduction font intervenir des molécules d’eau H2O, des protons H+ et des ions hydroxyles OH– pour assurer l’équilibre des charges électriques. Dans ce cas, le potentiel d’oxydoréduction dépend du pH. Pour un couple redox caractérisé par une demi-équation du type :

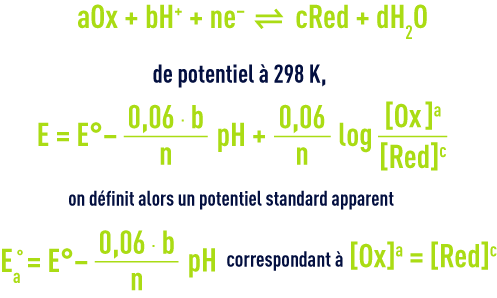
L’expression du potentiel d’oxydoréduction devient encore plus complexe lorsque les espèces oxydantes ou réductrices participent à des équilibres chimiques tels que les réactions acido-basiques, de complexation, de précipitation qui vont conduire à modifier le rapport [Ox]a/[Red]c en fonction du pH.
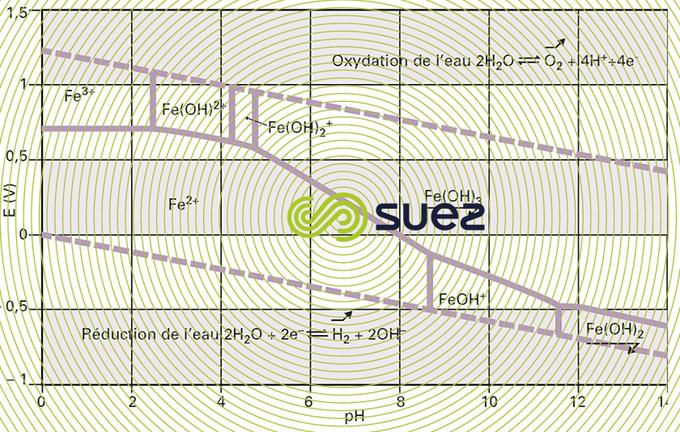
L’ensemble de ces phénomènes est décrit dans le diagramme potentiel-pH relatif à chaque élément chimique. Ce diagramme, également appelé diagramme de Pourbaix, présente les différents domaines thermodynamiques de prédominance et d’existence des formes redox de l’élément considéré en fonction du pH et du potentiel. La superposition des diagrammes relatifs aux éléments en présence permet alors de prévoir les réactions mises en jeu et leur sens d’évolution. Par exemple, le diagramme potentiel-pH du fer dans l’eau (figure 90) met en évidence que le fer ferreux est facilement oxydé en hydroxyde ferrique ou en ion ferrique par des oxydants relativement faibles comme l’iode ou l’oxygène. C’est pourquoi les eaux de surface bien aérées contiennent peu de fer soluble. Les traitements de déferrisation chimique appliquent ce principe : augmentation du potentiel redox pour transformer Fe2+ en Fe3+ qui précipite en hydroxyde ferrique.


Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












