membranes de dialyse
Temps de lecture :En dialyse ce sont les solutés qui migrent à travers la membrane qui est imperméable à l’eau. Les différents procédés se distinguent par la force motrice mise en jeu (différence de pression, de concentration ou de potentiel électrique) et par le type de membrane utilisée.
piézodialyse (gradient de pression et membranes amphotères)
Pas d'application industrielle.
dialyse simple (gradient de concentration)
Les impuretés migrent pour égaliser le potentiel chimique (sels et solutés organiques de faible masse molaire) de part et d’autre de la membrane ; si l'on renouvelle suffisamment la phase en cours de concentration, on peut obtenir une élimination quasi totale des impuretés.
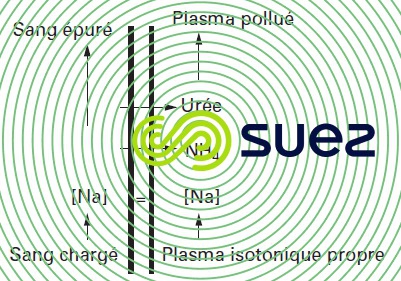
La principale application est l'hémodialyse (figure 65 - rein artificiel) qui permet d'épurer le sang (élimination des sels, urée, ...) des déficients rénaux, en le mettant en contact via une membrane mésoporeuse avec une solution de dialyse contenant des sels minéraux. La membrane permet le passage des sels et des composés azotés de faible poids moléculaires (urée, acide urique..) alors qu’elle retient totalement les protéines. Les éléments gênants sont ainsi les seuls à être éliminés et l’équilibre isotonique peut-être rétabli en ajustant la composition en sels de la solution de dialyse.


électrodialyse (gradient de champ électrique)
principe
Si un liquide riche en ions est soumis à un champ électrique grâce à deux électrodes entre lesquelles on applique une différence de potentiel continue, les cations vont se diriger vers l'électrode négative (ou cathode) tandis que les anions vont se diriger vers l'électrode positive (ou anode). Si rien ne s'oppose à leur mouvement, ils viennent se décharger sur les électrodes de signe contraire, il y a électrolyse.
En revanche, si l'on place entre les électrodes un ensemble de membranes de dialyse sélectives
- les unes, cationiques, perméables aux cations seulement,
- les autres, anioniques, perméables aux seuls anions, disposées alternativement comme l'indique la figure 66, on limite la migration des ions, car les anions ne peuvent traverser les membranes négatives, ni les cations les membranes positives

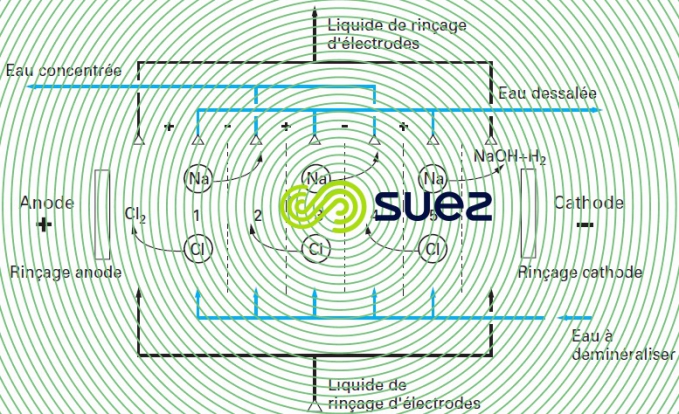

Ainsi, dans le cas de la cellule du schéma comportant trois paires de membranes, dont les compartiments 1, 2, 3, 4 et 5 sont alimentés par une solution de chlorure de sodium, les ions des compartiments 1, 3 et 5 passent dans les compartiments 2 et 4, sous l'effet du champ électrique créé par les électrodes.
Dans ces conditions l'eau des compartiments 1, 3 et 5 s'appauvrit en sel ("se déminéralise"), tandis que celle des compartiments 2 et 4 se concentre.
Pour chaque coulomb apporté au système, on observe donc la sortie d'une valence-gramme d'anions et de cations de chaque compartiment de déminéralisation (1, 3, 5), valence-gramme qui vient s'ajouter à celles déjà présentes dans les compartiments de concentration (2, 4).
La différence de potentiel étant proportionnelle au nombre de cellules, l'énergie nécessaire par kilogramme de sel éliminé est à peu près constante (0,6 à 0,8 kWh par kg de sel éliminé), ceci du moins tant que la conductivité électrique reste suffisante.
Ce procédé permet donc une déminéralisation de l'eau. Par contre, les molécules non ionisées et les colloïdes restent dans l'eau traitée ; c’est donc le cas de la silice quelle que soit sa forme ainsi que celui de la plupart des produits organiques dissous et de tous les microorganismes.
Les autres inconvénients du procédé sont:
- l'impossibilité d'obtenir des eaux fortement déminéralisées: en effet, les compartiments correspondants auraient des résistances électriques trop fortes, provoquant des pertes ohmiques. En général, il n'est pas raisonnable de vouloir réduire la salinité de l'eau produite à moins de 200 mg.l-1,
- un coût de l'eau croissant rapidement avec la salinité entrante; en effet
- d'une part, comme on l'a déjà vu, la puissance consommée est proportionnelle à la quantité de sels éliminée ;
- d'autre part, si l'on veut éviter des pertes de sélectivité dues à des rétro-diffusions d'ions sous l'effet d'un gradient de concentration trop élevé entre les deux faces de la membrane, il faut limiter ce gradient. Et de fait le marché de l’électrolyse est limité aux eaux ayant une salinité inférieure à 2 g/l.
- la limitation du taux d’élimination des sels : suivant l'hydraulique interne des électrodialyseurs (turbulences le long des membranes) on obtient au mieux un rendement d'élimination des sels de 70 à 85 % par passe (passage de sel compris entre 30 et 15 %) aussi une configuration avec recyclage ou en plusieurs passes (cf. figure 67) peut être requise.
- la nécessité de prétraitements :
- élimination de la turbidité (pour éviter les dépôts surtout dans les zones mal irriguées),
- réduction de la teneur en métaux, ex.: Fe et Aℓ < 0,3 mg.L-1, Mn < 0,1 mg.L-1, etc.
- réduction des sels susceptibles de précipiter dans les compartiments de concentration, ceci en tenant compte de la polarisation qui tend, dans le cas de l'électrodialyse non seulement à surconcentrer les ions de l'eau à traiter, mais également à changer le pH (surconcentration locale en ions OH- ou H+, ce qui peut renforcer la tendance à la précipitation de certains composés. Les membranes, de même nature chimique que les résines échangeuses d'ions, ont les mêmes limitations que celles-ci (voir principaux types d'échangeurs d'ions) en particulier sensibilité aux oxydants (Cℓ2 < 0,1 mg.l-1), et surtout risques d'empoisonnement irréversible des membranes anioniques, si l'eau à traiter contient des molécules organiques susceptibles de s'adsorber sur celles-ci.

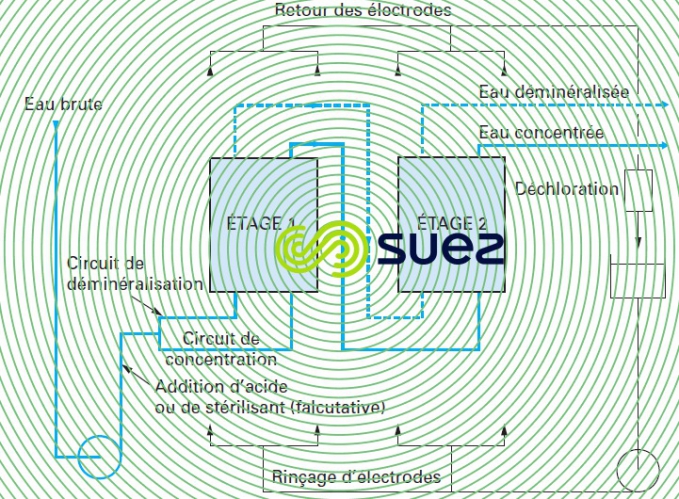

électrodialyse à inversion de polarité ("EDR")
Une solution élégante consiste, pour éviter les risques d'entartrage, à inverser régulièrement la polarité des électrodes (par exemple 5 min toutes les 30 à 60 min, et permuter ainsi instantanément compartiments de concentration et compartiments de dessalement et donc la position des couches de polarisation qui changent de côté de la membrane.
L'eau "produite" pendant ces phases d’inversion doit donc être rejetée.
Cette technique est prévue sur tous les postes d'électrodialyse modernes, car elle permet de simplifier le prétraitement au prix, il est vrai, d'une complication significative de l'installation :
- vannes automatiques pour permettre l'évacuation à l'égout lors des phases d'inversion,
- électrodes devant toutes résister à la corrosion anodique.
Le principal domaine de l'électrodialyse est le dessalement des solutions organiques, voire colloïdales, ex : dessalement du petit lait. Dans ce domaine, elle n'est en concurrence qu'avec les échangeurs d'ions. En effet, l'emploi de l'osmose inverse provoquerait dans un tel cas la concentration concomitante de toutes les espèces présentes et produirait de l'eau déminéralisée et un concentrat de petit lait, alors que l'électrodialyse n'élimine que les espèces ionisées. En traitement des eaux on l’utilise sur des eaux saumâtres peu salines (0,8 à 2 g/l) lorsque l’on ne recherche qu’une élimination partielle des sels (eau potable) elle est alors en concurrence directe avec l’osmose inverse basse pression, voire la nanofiltration (cf. Séparation par membranes).
On notera que toutes les installations industrielles utilisent des membranes planes montées dans des systèmes analogues aux filtres-presses.
électrodésionisation de l’eau
Au paragraphe précédent, on a décrit l’électrodialyse et expliqué pourquoi on ne peut l’utiliser pour déminéraliser économiquement l’eau à moins 150, voire 200 mg/L de salinité totale (cf. résistance électrique croissante des compartiments de dilution). Pour éviter cette difficulté on a imaginé il y a déjà 50 ans, de remplir lesdits compartiments par un lit mélangé de résine cationique et anionique forte parfaitement régénéré (forme H et OH-), cf. figure 68.

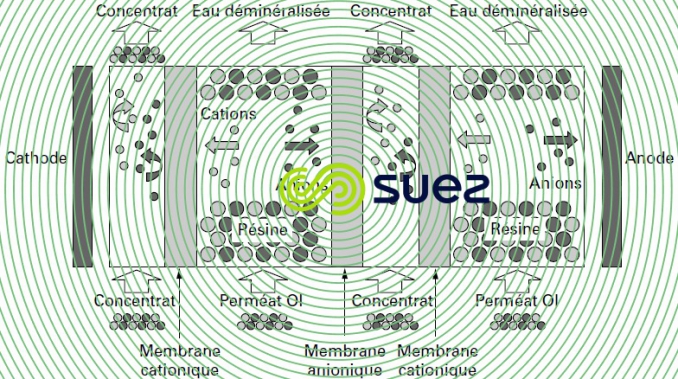


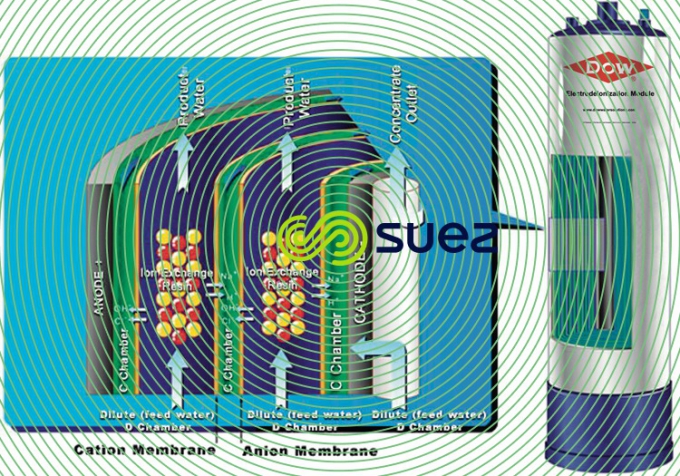




Le mécanisme de déminéralisation est alors le même que lors d’une électrodialyse, à l’exception notable de la conductibilité électrique des compartiments qui n’est plus due aux ions présents mais à la résine « compactée » entre les 2 membranes sélectives. Les ions migrent vers les électrodes en passant d’un grain de résine à l’autre jusqu’à atteindre la membrane sélective qui les transferts dans un des compartiments de concentration. (N.B. : ce transfert peut être décrit comme une succession de fixation puis de régénération électrique des résines).
Ceci permet donc de désioniser totalement l’eau et ceci au même niveau qu’un lit mélangé (cf. Mise en oeuvre des échangeurs d'ions) mais sans employer de réactifs chimiques.
En fait, il a fallu attendre les années 90 pour voir apparaître les désioniseurs modernes utilisant des compartiments dont l’épaisseur est réduite à quelques millimètres. Dans ces conditions, la résistance électrique des membranes de séparation ne peut plus être négligée.
L’empilement d’une série de compartiments avec leurs distributeurs d’eau à déminéraliser, leurs systèmes de reprise des concentrats et de balayage des électrodes, constitue une unité de base (suivant les fabricants elle permet de traiter de 1 à 15 m3/h), ensuite ces unités peuvent être facilement montées en parallèle.
Les limites du système sont :
- Vu la finesse des chenaux et la nécessité de laisser le lit mélangé de résine parfaitement propre (aucune possibilité de « décolmatage » du lit), l’eau utilisée doit être de qualité physique parfaite (absence de colloïde)
- Pour limiter les réactions aux électrodes, l’eau doit être déjà partiellement déminéralisée jusqu’à un minimum de 40 µS/cm.

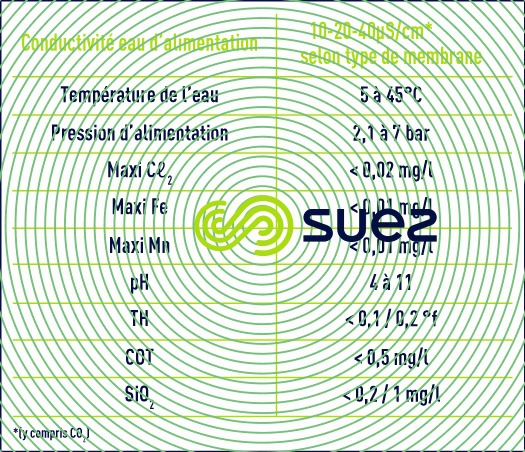

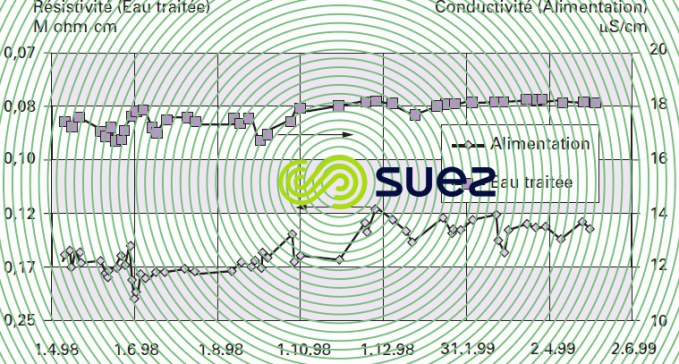
La combinaison de ces deux contraintes impose pratiquement d’utiliser l’EDI comme une étape de finition derrière une étape de déminéralisation par osmose inverse, voire de double osmose (série - perméat). Dans ce cas, la figure 69 montre des résultats typiques d’un an d’exploitation d’une EDI et le tableau 19 regroupe les qualités d’eau obtenue et les conditions d’exploitation de l’unité. (Attention les 2 échelles sont dissemblables).
Rappel : 10 µs/cm est équivalent à 0,1 MΩ.cm.





Consommation d’énergie 0,1 à 0,3 kWh.m3
On notera que :
- Les ions les moins bien retenus sont la Silice, le Bore, ainsi que les gaz dissous et principalement le CO2.
- Un effet bactéricide très intéressant pour les eaux ultrapures est dû aux valeurs élevées du pH (2 ou 11) dans les couches laminaires le long des grains de résines et des membranes.
Les emplois les plus classiques de l’EDI sont ceux requiérant de faibles quantités (< 50, voire 100 m3/h) d’eau ultrapure typique des eaux de process des industries de :
- l’électronique
- la pharmacie
- l’énergie.
Le Processus industriels et traitements des effluents résiduaires explicite l’emploi de l’électrodésionisation dans ces deux premiers cas. Dans le dernier, le principal intérêt est de ne pas nécessiter de réactif de régénération, ce qui est particulièrement intéressant pour les systèmes cherchant à minimiser les rejets, voire à aller jusqu’au 0 rejet.
La photo 8 montre, en atelier de montage, un système Centripur pour un laboratoire pharmaceutique, débit ~ 2,5 m3/h regroupant sur un même skid, les 2 étages de membranes (cf. 4 tubes de pression) et une électrodésionisation (cf. empilement type « filtre presse » à la base du skid).



Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












