principes de base - définitions
Temps de lecture :L’application d’une différence de potentiel entre deux électrodes plongées dans un bain électrolytique (solution contenant des ions) crée un champ électrique orienté dans lequel les ions se mettent en mouvement : les cations se dirigent vers la cathode, les anions vers l’anode. Quand la tension appliquée est suffisante, les réactions suivantes se produisent aux interfaces électrolyte-électrodes :

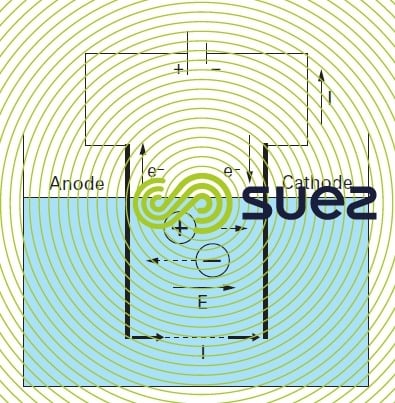

- à l’anode : oxydation avec émission d’électrons


- à la cathode : réduction avec capture d’électrons


relation de Nernst
À l’abandon dans un électrolyte (sous courant nul), une électrode prend une tension E. Cette tension, qui correspond à un équilibre entre les espèces présentes, est appelée potentiel d’équilibre et suit la relation de Nernst (voir oxydoréduction).

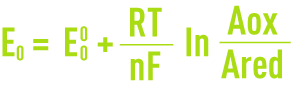
avec :
E0 : potentiel d’équilibre de l’électrode par rapport à l’ENH,
E0: potentiel d’équilibre de l’électrode dans les conditions standard (activités des espèces oxydantes et réductrices égales à l’unité),
R : constante molaire des gaz parfaits,
F : constante de Faraday,
T : température absolue,
n : nombre d’électrons mis en jeu dans le processus électrochimique,
Aox : activité de l’espèce oxydante,
Ared : activité de l’espèce réductrice.
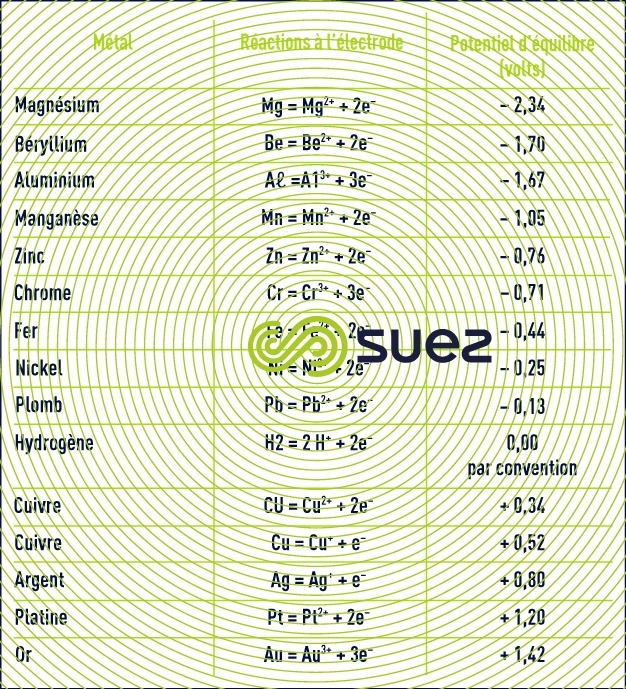
Le tableau 15 donne des valeurs du potentiel d’équilibre standard de quelques couples électrochimiques (à 25 °C par rapport à l’ENH).


tension d’électrolyse
En fonctionnement normal d’une cellule d’électrolyse, la tension V obéit à une loi de la forme

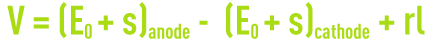
avec :
E0 : potentiel d’équilibre des électrodes,
s : surtension d’électrodes,
rI : chute ohmique due à la résistivité de l’électrolyte.
loi de Faraday
La loi de Faraday exprime la relation qui lie la quantité d’électricité traversant une cellule d’électrolyse à l’amplitude des réactions se produisant aux interfaces électrodes-électrolyte :

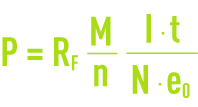
avec :
P : masse de constituant mise en jeu au cours de la réaction (g),
RF. : rendement de courant,
M : masse molaire du constituant (g),
I·t : quantité d’électricité traversant la cellule (C),
n : nombre d’électrons-grammes échangés lors de la réaction,
N : nombre d’Avogadro = 6,02·1023 pour une mole,
e0 : charge de l’électron = 1,6 10–19 C.
Outil Marque-page
Cliquez sur l'outil marque-page, puis surlignez le dernier paragraphe lu pour pouvoir poursuivre ultérieurement votre lecture.












